题目内容
9.某溶液中含有大量NH4+、Na+、HCO3ˉ、CO32ˉ、CH3COO-,加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )| A. | Na+ | B. | CO32ˉ | C. | CH3COO- | D. | NH4+ |
分析 Na2O2与水反应生成氢氧化钠,溶液呈碱性,Na2O2具有强氧化性,能与OH-反应的离子和具有还原性的离子的浓度会发生改变.同时溶液中存在反应生成的离子,该离子浓度也会变化.
解答 解:A、Na2O2与水反应生成氢氧化钠,溶液呈碱性,Na+浓度增加,故A错误;
B、HCO3-与OH-反应生成CO32-,则HCO3-离子浓度减小,CO32-离子浓度增大,故B错误;
C、加入足量过氧化钠,溶液中生成氢氧化钠和氧气,CH3COO--浓度基本不变,故C正确;
D、Na2O2与水反应生成氢氧化钠,NH4+与OH-反应生成氨水,NH4+浓度会减少,故D错误;
故选C.
点评 本题考查Na2O2的性质以及离子反应,注意过氧化钠的强氧化性,熟悉离子之间的反应即可解答,难度不大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
19.化学上通常把原子数和电子数相等的分子或离子称为等电子体,人们发现等电子体间的结构和性质相似(即等电子原理),B3N3H6被称为无机苯,它与苯是等电子体,则下列说法中不正确的是( )
| A. | 无机苯是由极性键组成的非极性分子 | |
| B. | 无机苯能发生加成反应和取代反应 | |
| C. | 无机苯不能使KMnO4酸性溶液褪色 | |
| D. | 无机苯的二氯取代物有3种同分异构体 |
4.图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)表中某元素最高正价氧化物的水化物与其氢化物之间能相互反应生成离子化合物,则该离子化合物的名称是硝酸铵,由元素④、⑥、⑦、⑧形成的简单离子的半径由大到小的顺序是Cl->O2->Na+>Al3= (用离子符号表示,下同).③、④、⑤元素的氢化物的沸点由高到低的顺序是H2O>HF>NH3.
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该离子反应方程是NH4++OH-=NH3+H2O.
(3)由表中四种元素形成X、Y、Z、M、N等常见物质,X、Y含有一种相同元素,其中X焰色反应呈黄色,可发生以下反应:

①X、Y与水混合后反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓.
②N→⑦的单质反应的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
③若将Y溶液加热蒸干、灼烧后得到的物质的化学式是Al2O3.
 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | |||||
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该离子反应方程是NH4++OH-=NH3+H2O.
(3)由表中四种元素形成X、Y、Z、M、N等常见物质,X、Y含有一种相同元素,其中X焰色反应呈黄色,可发生以下反应:

①X、Y与水混合后反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓.
②N→⑦的单质反应的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
③若将Y溶液加热蒸干、灼烧后得到的物质的化学式是Al2O3.
14.如图所示,将铁棒和石墨棒插入1L 1mol•L-1食盐水中.下列说法正确的是( )


| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与N连接,正极反应式是4OH--4e-═2H2O+O2↑ | |
| C. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| D. | 若电键K与M连接,当C电极共产生11.2L(标准状况)气体时,生成了1 mol NaOH |
1.下列说法中正确的是( )
| A. | 苯使溴水层褪色属于加成反应 | |
| B. | 乙烯与水反应生成乙醇属于水解反应 | |
| C. | 同二甲苯只有一种结构说明苯分子中不存在单双链交替 | |
| D. | 等质量环丁烷(C4H8)和乙烯(C2H4)完全燃烧,消耗的氧气量相等 |
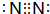 ,物质甲分子的结构式
,物质甲分子的结构式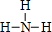 .
. .
. 邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g•cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂.某实验小组的同学用右图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置己略去),主要操作步骤如下:
邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g•cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂.某实验小组的同学用右图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置己略去),主要操作步骤如下: