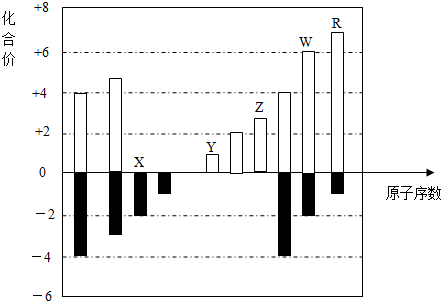
题目内容
17.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量.写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640kJ•mol-1.
分析 0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量,则1mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出热量为$\frac{256}{0.4}$=640kJ,结合物质的状态书写热化学方程式.
解答 解:0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量,则1mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出热量为$\frac{256}{0.4}$=640kJ,则该反应的热化学方程式为N2H4(l)+2 H2O2(l)=N2(g)+4H2O(g)△H=-640 kJ•mol-1,
故答案为:N2H4(l)+2 H2O2(l)=N2(g)+4H2O(g)△H=-640 kJ•mol-1.
点评 本题考查热化学反应方程式的书写,为高频考点,把握物质的量与热量的关系、物质的状态为解答的关键,侧重分析与应用能力的考查,注意热化学方程式的书写方法,题目难度不大.

练习册系列答案
相关题目
7.葡萄糖的结构简式为:CH2OH-CHOH-CHOH-CHOH-CHOH-CHO其对应的性质中不正确的是( )
| A. | 1mol葡萄糖最多可以与5mol金属钠反应放出氢气 | |
| B. | 1mol葡萄糖最多可以与5mol乙酸发生取代反应 | |
| C. | 能发生银镜反应 | |
| D. | 可与小苏打溶液反应冒出气泡 |
12.下列选用的相关仪器符合实验要求的是( )
| A. | 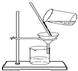 分离FeCl3溶液和蔗糖溶液 | B. |  称量8.55g氯化钠固体 | ||
| C. | 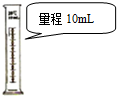 量取9.50 mL水 | D. | 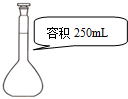 配制240 mL 0.1mol/L的NaCl溶液 |
2.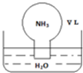 标准状况下,将体积为VL的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出(无NH3•H2O、NH4+、NH3)扩散到水槽中),所得溶液的密度为ρg•cm-3.下列说法正确的是( )
标准状况下,将体积为VL的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出(无NH3•H2O、NH4+、NH3)扩散到水槽中),所得溶液的密度为ρg•cm-3.下列说法正确的是( )
 标准状况下,将体积为VL的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出(无NH3•H2O、NH4+、NH3)扩散到水槽中),所得溶液的密度为ρg•cm-3.下列说法正确的是( )
标准状况下,将体积为VL的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出(无NH3•H2O、NH4+、NH3)扩散到水槽中),所得溶液的密度为ρg•cm-3.下列说法正确的是( )| A. | 条件不足,不能计算所得溶液的物质的量浓度 | |
| B. | 所得溶液中,n(NH3•H2O)+n(NH4+)+n(NH3)=$\frac{V}{22.4}$ | |
| C. | 所得溶液的质量分数为$\frac{17ρ}{22400}$ | |
| D. | 水最终不可能充满整个烧瓶 |
9.化学与生活密切相关,下列有关说法正确的是( )
| A. | 用聚氯乙烯塑料袋包装食品 | |
| B. | 糖类、蛋白质、油脂属于天然高分子化合物 | |
| C. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| D. | 煤经气化和液化两个物理变化过程,可变为清洁能源 |
6.下列物质的水溶液因水解呈酸性的是( )
| A. | NaOH | B. | Na2CO3 | C. | NH4Cl | D. | HCl |
 .合成M的一种途径如下:
.合成M的一种途径如下:
 .
. .
. .
.