题目内容
(12分)I.硝酸铜在1000℃时分【解析】
Cu(NO3)2=Cu+2NO2↑+O2,用试管收集一试管气体并倒立于盛水的水槽中,观察到的现象是 ,若溶质不扩散,试管内溶液中溶质的物质的量浓度是 (假设在标准状况下)。
II.工业上生产硝酸铜晶体的流程图如下:
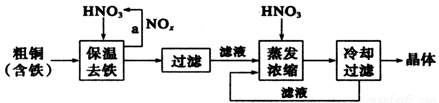
①若保温去铁反应生成气体是NO时,则离子方程式是 。
②蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是 (结合离子方程式说明)。
③如图所示为硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),从图中获取如下信息,不正确的有 (填字母)。

a.C点溶液为Cu(NO3)2的不饱和溶液
b.30℃时结晶可析出两种晶体
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.将A点溶液升温至30℃时,可以析出Cu(NO3)2·3H2O晶体
④某些共价化合物(如H2O、NH3、N2O4等)在液态时发生了微弱的电离,如:2H2O OH—+H3O+, 则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,其反应的化学方程式是 。
OH—+H3O+, 则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,其反应的化学方程式是 。
Ⅰ.红棕色气体溶解成无色溶液,试管中的气柱为无色(2分)
0.036 mol·L-1或1/28 mol·L-1
Ⅱ.①3Fe + 8H+ + 2NO3- = 3Fe2++ 2NO↑ + 4H2O(2分)
②由于Cu2+发生水解:Cu2++2H2O Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
③c、d(2分) ④ 2NH3 NH4++NH2- (1分) Cu+2N2O4=Cu(NO3)2+2NO↑(2分)
NH4++NH2- (1分) Cu+2N2O4=Cu(NO3)2+2NO↑(2分)
【解析】
试题分析:I.二氧化氮、氧气和水反应生成硝酸,化学方程式为4NO2+O2+2H2O=4HNO3,用试管收集一试管气体并倒立于盛水的水槽中,观察到的现象是红棕色气体溶解成无色溶液,试管中的气柱为无色,剩余气体为氧气;设二氧化氮为2mol,氧气为1mol,根据反应方程式知生成的硝酸为2mol,剩余气体0.5mol,进入试管内液体的体积为2.5mol×22.4L/mol=56L,即为稀硝酸的体积,试管内溶液中溶质的物质的量浓度c=n/V=2mol/56L=0.036 mol·L-1或1/28 mol·L-1;II.①保温去铁是铁与硝酸反应生成硝酸亚铁、一氧化氮和水,离子方程式是3Fe + 8H+ + 2NO3- = 3Fe2++ 2NO↑ + 4H2O;②蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是由于Cu2+发生水【解析】
Cu2++2H2O Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解;③ a.根据题给图像知,溶解度曲线上的点对应的溶液为饱和溶液,C点在曲线的下方,溶液为Cu(NO3)2的不饱和溶液,正确;b.根据题给图像知,30℃时结晶可析出两种晶体,正确;c.上述流程在低温下进行,最终得到的晶体是Cu(NO3)2·6H2O,错误;d.将A点溶液升温至30℃时,溶液为不饱和溶液,无晶体析出;④迁移题给水的电离方程式:2H2O
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解;③ a.根据题给图像知,溶解度曲线上的点对应的溶液为饱和溶液,C点在曲线的下方,溶液为Cu(NO3)2的不饱和溶液,正确;b.根据题给图像知,30℃时结晶可析出两种晶体,正确;c.上述流程在低温下进行,最终得到的晶体是Cu(NO3)2·6H2O,错误;d.将A点溶液升温至30℃时,溶液为不饱和溶液,无晶体析出;④迁移题给水的电离方程式:2H2O OH—+H3O+,则液态NH3电离的方程式是2NH3
OH—+H3O+,则液态NH3电离的方程式是2NH3 NH4++NH2-,液态N2O4电离得到电子数相差18的阴阳离子,则液态四氧化二氮的电离方程式为2N2O4
NH4++NH2-,液态N2O4电离得到电子数相差18的阴阳离子,则液态四氧化二氮的电离方程式为2N2O4 NO++NO3-,根据原子守恒和电子守恒得用Cu与液态N2O4反应制备无水硝酸铜的化学方程式是Cu+2N2O4=Cu(NO3)2+2NO↑。
NO++NO3-,根据原子守恒和电子守恒得用Cu与液态N2O4反应制备无水硝酸铜的化学方程式是Cu+2N2O4=Cu(NO3)2+2NO↑。
考点:考查氮的氧化物的性质,溶解度曲线,盐类水解,化学工艺流程分析。



 xC(g),△H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g),△H<0。测得两容器中c(A)随时间t的变化如图所示:

