题目内容
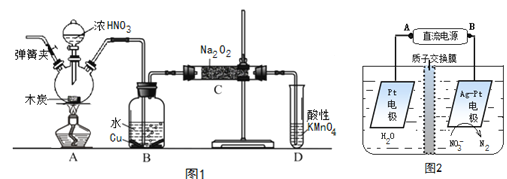
【题目】亚硝酸钠(NaNO2)是重要的防腐剂。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图1所示(部分夹持装置略)。
已知:
①2NO+Na2O2→2NaNO2
②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
回答下列问题:
(1)写出浓硝酸与木炭反应的化学方程式_____________________________________________;
(2)B中观察到的主要现象是___________________________________________________________,
D装置的作用是______________________________________________;
(3)检验C中产物有亚硝酸钠的方法是______________________________________________;
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和____________,为避免产生这些副产物应在B、C装置间增加装置E,仪器E的名称是___________,E中盛放的试剂应是_________(填字母);
A.浓H2SO4B.碱石灰 C.无水CaCl2
(5)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭___________g 。
(6)反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理,电化学降解NO3-的原理如上图2所示。25℃时,反应进行10min,溶液的pH由7变为12 。
电源正极为________(填A或B),阴极反应式为___________________________________________。
【答案】C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 铜片逐渐溶解,溶液变为蓝色,有无色气体产生 吸收未反应的NO 取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色 氢氧化钠 干燥管 B 0.36g A 2NO3- +6H2O +10e-=N2↑+12OH-
CO2↑+4NO2↑+2H2O 铜片逐渐溶解,溶液变为蓝色,有无色气体产生 吸收未反应的NO 取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色 氢氧化钠 干燥管 B 0.36g A 2NO3- +6H2O +10e-=N2↑+12OH-
【解析】
(1)硝酸与木炭反应,硝酸做氧化剂被还原为NO2,木炭做还原剂被还原为CO2,浓硝酸与木炭反应的化学方程式 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,答案为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)NO2溶于水生成硝酸,硝酸和Cu反应生成NO,所以可以看到的现象为,铜牌溶解,溶液变成蓝色,有气体产生,产生的NO和Na2O2反应生成NaNO2,未反应完的NO被D中的高锰酸钾氧化,以免污染空气,答案为:铜片逐渐溶解,溶液变为蓝色,有无色气体产生; 吸收未反应的NO;
(3)3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O,检验C中产物有亚硝酸钠的方法是取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色,答案为:取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色;
(4)反应过程中CO2和H2O没有出去,所以C中副产物有碳酸钠、氢氧化钠,同时除去CO2和H2O,最好选用碱石灰做干燥剂,盛装仪器为干燥管,答案为:氢氧化钠; 干燥管;B;
(5)根据2n(Na2O2)~n(NaNO2)~n(NO)~1/3n(NO2)~3n(C),所以有n(C)= 3/2n(Na2O2)=3/2×1.56g/78g/mol=0.03mol,需要C的质量为0.03mol×12g/mol=0.36g,答案为:0.36g;
(6)电解池中阳极发生氧化反应,电源B极发生的是还原反应为阴极,那么A极是阳极,阴极反应式为2NO3- +6H2O +10e-=N2↑+12OH-,答案为:A,2NO3- +6H2O +10e-=N2↑+12OH-.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,发生反应N2(g)+3H2(g)![]() 2NH3(g) ΔH= 92.4kJ/mol,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= 92.4kJ/mol,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 0.5mol N2、1.5mol H2 | 1mol NH3 | 2mol NH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
吸收或放出的热量(kJ) | a | b | c |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | ɑ1 | ɑ2 | ɑ3 |
下列说法正确的是
A.a + b = 46.2B.2c1>c3>c1C.2p2<p3D.ɑ1+ɑ3>1