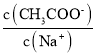题目内容
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
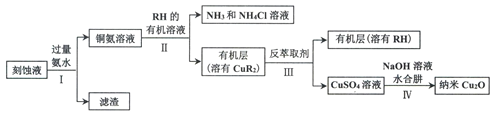
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 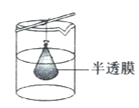
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
【答案】Cu(NH3)42++2RH=2NH4++2NH3+CuR2 提高铜离子的萃取率,提高原料利用率 稀硫酸 pH太小氧化亚铜会发生歧化反应,pH太大,氧化亚铜会溶解 C 真空干燥 90.90% 制备氧化亚铜时,氧化亚铜被肼还原,产品中含有铜粉,测定结果均增大
【解析】
刻蚀液(含有大量Cu2+、Fe2+、Fe3+)加入过量的氨水,形成铜氨溶液,同时生成氢氧化亚铁和氢氧化铁沉淀,铜氨溶液中加入有机溶液得到CuR2,再反萃取剂条件下生成硫酸铜溶液。
(1)步骤II,铜氨溶液和RH的有机溶液反应生成氨气和氯化铵和CuR2,离子方程式为:Cu(NH3)42++2RH=2NH4++2NH3+CuR2;
(2)需要对水层多次萃取并合并萃取液是能提高铜离子的萃取率,提高原料利用率;
(3)通过前后的物质分析,反萃取剂提供硫酸根离子和氢离子,故为稀硫酸;
(4)①从信息分析,氧化亚铜在酸性强的溶液中会发生歧化反应,但碱性强的溶液中氧化亚铜会溶解。故答案为:pH太小氧化亚铜会发生歧化反应,pH太大,氧化亚铜会溶解;
②纳米Cu2O不能通过半透膜,所以可以选择C进行分离。
③因为Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu,所以选择真空干燥;
(5)①根据得失电子分析关系式有5Cu2O---2KMnO4,高锰酸钾的物质的量为0.200 0 moI.L-1×0.05L=0.01mol,则氧化亚铜的物质的量为0.025mol,质量分数为![]() =90.90%;
=90.90%;
②制备氧化亚铜时,肼具有还原性,氧化亚铜被肼还原,产品中含有铜粉,测定结果均增大。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】硝酸亚铁可用作媒染剂、分析试剂、催化剂等。
(1)硝酸亚铁可用铁屑在低温下溶于稀硝酸制得,还原产物为NO。反应的化学方程式为________。
(2)某小组为探究硝酸亚铁晶体的热分解产物,按下图所示装置进行实验。
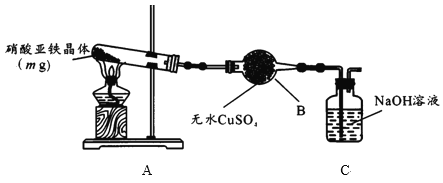
①仪器B的名称是____,实验中无水CuSO4变蓝,由此可知硝酸亚铁晶体含有___。
②实验中观察到A装置的试管中有红棕色气体生成,检验热分解后固体为氧化铁的实验方案为:
实验步骤 | 现象 |
取少量固体加适量稀硫酸,振荡,将溶液分成两份 | 固体溶解得黄色溶液 |
一份滴入____ | 溶液变成红色 |
另一份滴入1~2滴K3 [Fe(CN)6]溶液 | ___________ |
A中硝酸亚铁晶体[Fe(NO3)2·xH2O]分解的化学方程式为______ 。
(3)继续探究mg硝酸亚铁晶体中铁元素的质量分数
①取A中热分解后的固体放入锥形瓶,用稀硫酸溶解,加入过量的KI溶液,滴入2滴___作指示剂。
②用a mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液(已知:I2+2S2O32-=2I-+S4O62-),滴定至终点时用去bmLNa2S2O3溶液,则硝酸亚铁晶体中铁的质量分数为______。