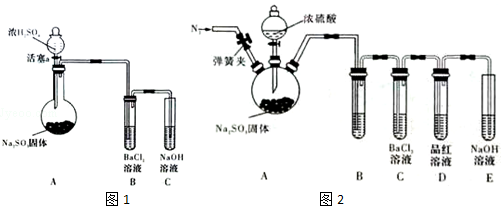
题目内容
17.0.154mol/L的NaCl溶液的渗透液浓度(mmol/L表示)为( )| A. | 0.308 | B. | 308 | C. | 154 | D. | 0.154 |
分析 0.154mol/L的NaCl溶液的渗透液浓度用mmol/L表示,1mol=1000mmol
解答 解:0.154mol/L的NaCl溶液的渗透液浓度用mmol/L表示,1mol=1000mmol,0.154mol/L的NaCl溶液的渗透液浓度(mmol/L表示)为154mmol/L,故选C.
点评 本题考查了浓度单位换算,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
7.如图为空气成分示意图(按体积计算),其中“a”代表的是( )


| A. | 氧气 | B. | 氮气 | C. | 二氧化碳 | D. | 稀有气体 |
8.反应4A(s)+3B(g)═2C(g)+xD(g),经2min后B的浓度减少了1.2mol/L,下列反应速率的表示正确的是( )
| A. | 用A表示的反应速率是0.8mol/(L•min) | |
| B. | 2min末时的反应速率,用B表示为0.6mol/(L•min) | |
| C. | 用C表示的反应速率是0.4mol/(L•min) | |
| D. | 若用D表示反应速率是0.8mol/(L•min),则x=2 |
12.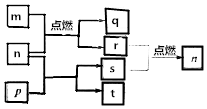 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )| A. | Y、Z、W的简单离子的电子层结构相同 | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | 简单氢化物的稳定性:X>Y | |
| D. | Y与Z两种元素形成的化合物一定只含离子键 |
2.a、b、c三种元素的原子序数均小于18,其离子的电子层结构相同,原子半径a>c,离子半径b>a,b和c能形成离子化合物,由此可判断三种元素原子序数的关系为( )
| A. | b>a>c | B. | a>c>b | C. | c>a>b | D. | c>b>a |
3.亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌.以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
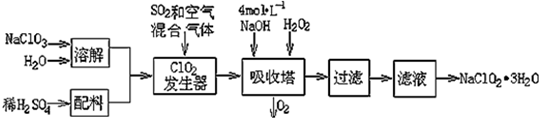
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O;
②Ksp(FeS)=6.3×10-18; Ksp(CuS)=6.3×10-36;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2.若用二氧化氯和浓盐酸制取Cl2,当生成5mol Cl2时,通过还原反应制得氯气的质量为71g.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是dc (填写序号).
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e.蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.
表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2)(用化学式表示);体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:前者大(填“前者大”“相等”或“后者大”).
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1),此时体系中的S2-的浓度为6.3×10-13mol/L.

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O;
②Ksp(FeS)=6.3×10-18; Ksp(CuS)=6.3×10-36;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2.若用二氧化氯和浓盐酸制取Cl2,当生成5mol Cl2时,通过还原反应制得氯气的质量为71g.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是dc (填写序号).
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e.蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.
表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1),此时体系中的S2-的浓度为6.3×10-13mol/L.