题目内容
5.常温下,将0.01mol的NH4Cl和0.002mol NaOH溶于水配成溶液.(1)该溶液中存在的平衡体:NH4++OH-?NH3•H2O;NH4++H2O?NH3•H2O+H+;;H2O?H++OH-.
(2)溶液中共有8种不同的粒子.
(3)这些粒子中浓度为0.01mol•L-1的是Cl-,浓度为0.002mol•L-1是Na+.
(4)物质的量之和是0.01mol的三种微粒是:NH4+、NH3•H2O、NH3.
分析 (1)氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中存在铵根离子水解平衡,一水合氨形成的化学平衡,水的电离平衡;
(2)依据溶液中平衡状态和存在的微粒分析;
(3)这些微粒中浓度为0.01mol/L的是Cl-,浓度为0.002mol/L的是Na+;
(4)依据物料守恒分析物质的量之和为0.01mol的微粒.
解答 解:常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L溶液,溶液中存在0.002molNaCl,0.002molNH3•H2O,0.008mol NH4Cl.
(1)该溶液中存在的三个平衡体系是铵根离子的水解平衡NH4++H2O?NH3•H2O+H+,铵根离子和氢氧根离子发生反应的化学平衡NH4++OH-?NH3•H2O,弱电解质的电离平衡 H2O?H++OH-;
故答案为:NH4++OH-?NH3•H2O;NH4++H2O?NH3•H2O+H+;H2O?H++OH-;
(2)溶液中存在的微粒为NH4+、OH-、H+、Na+、Cl-、NH3•H2O、H2O,共8种微粒;
故答案为:8;
(3)这些微粒中氯离子、钠离子物质的量不变,所以浓度为0.01mol/L的是Cl-,浓度为0.002mol/L的是Na+;
故答案为:Cl-,Na+;
(4)物料守恒分析,物质的量之和为0.01mol的三种微粒是NH4+、NH3•H2O、NH3.
故答案为:NH4+、NH3•H2O、NH3.
点评 本题考查了弱电解质电离,盐类水解分析应用,明确电解质溶液中电荷守恒、物料守恒,掌握物质性质即可解答,题目难度中等.

练习册系列答案
相关题目
15.将30mL 0.5mol/L的NaOH溶液加水稀释到500mL,稀释后NaOH的物质的量浓度为( )
| A. | 0.3 mol/L | B. | 0.03 mol/L | C. | 0.05 mol/L | D. | 0.04 mol/L |
16.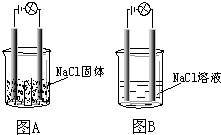 某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )
某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )
 某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )
某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在水溶液中电离出了可以自由移动的离子 | |
| D. | 在NaCl溶液中,水电离出了大量的离子 |
13.下列说法不正确的是( )
| A. | 常温下,可以用铁、铝制的容器来盛装浓硫酸或浓硝酸 | |
| B. | 实验室中,盛装NaOH溶液的试剂瓶用橡皮塞 | |
| C. | 实验室中,可以用量筒、滴定管、容量瓶准确量取一定体积的液体用于化学反应等 | |
| D. | 实验室中,盛放氢氟酸不能用玻璃瓶 |
20.标准状态下,气态分子断开l mol化学键的焓变称为键能.已知H-H、H-O和O═O键的键能△H分别为436kJ/mol、463kJ/mol和495kJ/mol.下列热化学方程式正确的是( )
| A. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H═-485 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(g);△H═-485 kJ/mol | ||
| C. | 2H2(g)+O2 (g)═2H2O(g);△H═+485 kJ/mol | D. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H═+485 kJ/mol |
17.下列说法不正确的是( )
| A. | 中和热测定实验中,应迅速将NaOH溶液和盐酸在测定装置中混合 | |
| B. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| C. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 | |
| D. | 已知4H++4I-+O2=2I2+2H2O,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol•L-1KI溶液、0.1 mol•L-1稀硫酸外,还需要用到淀粉溶液 |
15.下列说法正确的是( )
| A. | 将AgBr放入水中不能导电,故AgBr不是电解质 | |
| B. | CO2溶于水得到的溶液能导电,所以CO2是电解质 | |
| C. | 熔融的金属能导电,所以金属是电解质 | |
| D. | 固态的NaCl不导电,但 NaCl是电解质 |