题目内容
炼铁高炉中的原理如下:
Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)
(1)写出该反应的化学平衡常数表达式K=
(2)CO的转化率(α)在不同温度下随反应时间(t)的变化如图a,由此图可得出:
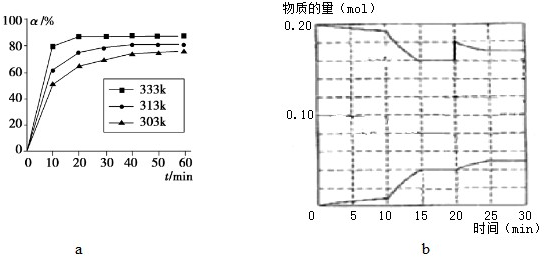
①温度对该反应的反应速率和平衡移动的影响是
②该反应的△H 0 (填“<”、“=”或“>”).
(3)600℃时,在体积为1L的密闭容器中,投入0.20mol CO和足量Fe2O3,反应过程中CO、CO2物质的量变化如图b.
①在相同条件下,往相同容器中投入等量CO、CO2及足量的Fe2O3、Fe,此时反应向 (填写“向正反应方向”、“向逆反应方向”、“已达到平衡状态”).经过一段时间的反应,下列说法中能说明该反应达到了化学平衡状态的是 .
A.容器内压强一定 B.容器内气体的密度一定
C.v正(CO):v逆(CO2)=1:1 D.容器内气体的质量一定
②据图b判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号).
A.加了催化剂 B.缩小容器体积 C.通入一定量He.
Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)
(1)写出该反应的化学平衡常数表达式K=
(2)CO的转化率(α)在不同温度下随反应时间(t)的变化如图a,由此图可得出:

①温度对该反应的反应速率和平衡移动的影响是
②该反应的△H
(3)600℃时,在体积为1L的密闭容器中,投入0.20mol CO和足量Fe2O3,反应过程中CO、CO2物质的量变化如图b.
①在相同条件下,往相同容器中投入等量CO、CO2及足量的Fe2O3、Fe,此时反应向
A.容器内压强一定 B.容器内气体的密度一定
C.v正(CO):v逆(CO2)=1:1 D.容器内气体的质量一定
②据图b判断,反应进行至20min时,曲线发生变化的原因是
A.加了催化剂 B.缩小容器体积 C.通入一定量He.
考点:化学平衡常数的含义,化学平衡的影响因素,化学平衡状态的判断,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)依据化学方程式和平衡常数概念书写平衡常数表达式;
(2)依据图象分析,用“定一议二”的方法分析判断;
(3)①依据图象变化计算600°C的平衡常数,结合加入量计算浓度商和 平衡常数比较判断反应进行的方向;结合反应特征达到平衡的标志是正逆反应速率相同,各组分浓度保持不变分析选项;
②反应进行至20min时一氧化碳突然增大0.02mol,此时二氧化碳不变,随反应进行一氧化碳减小,二氧化碳增大,最后达到平衡状态,说明平衡正向进行;10min到15min的曲线变化斜率增大但最后达到平衡状态,反应是气体体积不变的反应,速率增大说明改变的是加入催化剂,或增大压强.
(2)依据图象分析,用“定一议二”的方法分析判断;
(3)①依据图象变化计算600°C的平衡常数,结合加入量计算浓度商和 平衡常数比较判断反应进行的方向;结合反应特征达到平衡的标志是正逆反应速率相同,各组分浓度保持不变分析选项;
②反应进行至20min时一氧化碳突然增大0.02mol,此时二氧化碳不变,随反应进行一氧化碳减小,二氧化碳增大,最后达到平衡状态,说明平衡正向进行;10min到15min的曲线变化斜率增大但最后达到平衡状态,反应是气体体积不变的反应,速率增大说明改变的是加入催化剂,或增大压强.
解答:
解:(1)Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g),依据化学方程式和平衡常数概念书写平衡常数表达式K=
;
故答案为:
;
(2)①图象变化曲线说明温度越高反应达到平衡的时间越短,所以升温加快反应速率,温度越高一氧化碳转化率越大,说明升温平衡正向进行;
故答案为:温度升高反应速率增大,平衡正向进行;
②温度越高一氧化碳转化率越大,说明升温平衡正向进行,正反应是吸热反应,△H>0;
故答案为:>;
(3)①600℃时,在体积为1L的密闭容器中,投入0.20mol CO和足量Fe2O3,反应过程中CO、CO2物质的量变化如图b,平衡状态一氧化碳n(CO)=0.16mol,n(CO2)=0.04mol,
Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)
起始量(mol) 0.20 0
变化量(mol) 0.04 0.04
平衡量(mol) 0.16 0.04
反应前后气体物质的量不变,用物质的量代替平衡浓度计算平衡常数K=
=
;
在相同条件下,往相同容器中投入等量CO、CO2及足量的Fe2O3、Fe,Q=1>K,说明平衡逆向进行;达到平衡状态
A.反应过程中和平衡状态下气体物质的量不变,压强之比等于物质的量之比,容器内压强一定,不能说明费用达到平衡状态,故A错误;
B.反应前后气体质量发生变化,体积不变,容器内气体的密度一定,说明费用达到平衡状态,故B正确;
C.反应速率之比等于化学方程式系数之比,是正反应速率之比,v正(CO):v逆(CO2)=1:1,说明二氧化碳正逆反应速率相同,反应达到平衡状态,故C正确;
D.反应前后气体质量分数变化,容器内气体的质量一定,说明费用达到平衡状态,故D正确;
故答案为:向逆反应方向;BCD;
②据图b判断,反应进行至20min时,曲线发生变化的原因是一氧化碳突然增大0.02mol,此时二氧化碳不变,随反应进行一氧化碳减小,二氧化碳增大,最后达到平衡状态,说明平衡正向进行;10min到15min的曲线变化斜率增大但最后达到平衡状态,反应是气体体积不变的反应,速率增大说明改变的是加入催化剂,或增大压强,所以AB正确;
故答案为:通入0.02molCO;AB.
| c3(CO2) |
| c3(CO) |
故答案为:
| c3(CO2) |
| c3(CO) |
(2)①图象变化曲线说明温度越高反应达到平衡的时间越短,所以升温加快反应速率,温度越高一氧化碳转化率越大,说明升温平衡正向进行;
故答案为:温度升高反应速率增大,平衡正向进行;
②温度越高一氧化碳转化率越大,说明升温平衡正向进行,正反应是吸热反应,△H>0;
故答案为:>;
(3)①600℃时,在体积为1L的密闭容器中,投入0.20mol CO和足量Fe2O3,反应过程中CO、CO2物质的量变化如图b,平衡状态一氧化碳n(CO)=0.16mol,n(CO2)=0.04mol,
Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)
起始量(mol) 0.20 0
变化量(mol) 0.04 0.04
平衡量(mol) 0.16 0.04
反应前后气体物质的量不变,用物质的量代替平衡浓度计算平衡常数K=
| 0.043 |
| 0.163 |
| 1 |
| 64 |
在相同条件下,往相同容器中投入等量CO、CO2及足量的Fe2O3、Fe,Q=1>K,说明平衡逆向进行;达到平衡状态
A.反应过程中和平衡状态下气体物质的量不变,压强之比等于物质的量之比,容器内压强一定,不能说明费用达到平衡状态,故A错误;
B.反应前后气体质量发生变化,体积不变,容器内气体的密度一定,说明费用达到平衡状态,故B正确;
C.反应速率之比等于化学方程式系数之比,是正反应速率之比,v正(CO):v逆(CO2)=1:1,说明二氧化碳正逆反应速率相同,反应达到平衡状态,故C正确;
D.反应前后气体质量分数变化,容器内气体的质量一定,说明费用达到平衡状态,故D正确;
故答案为:向逆反应方向;BCD;
②据图b判断,反应进行至20min时,曲线发生变化的原因是一氧化碳突然增大0.02mol,此时二氧化碳不变,随反应进行一氧化碳减小,二氧化碳增大,最后达到平衡状态,说明平衡正向进行;10min到15min的曲线变化斜率增大但最后达到平衡状态,反应是气体体积不变的反应,速率增大说明改变的是加入催化剂,或增大压强,所以AB正确;
故答案为:通入0.02molCO;AB.
点评:本题考查了化学平衡常数影响因素和计算应用,图象变化的分析判断、平衡标志的分析判断是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下各组物质中,属于同分异构体的是( )
| A、O2和O3 | ||||
B、
| ||||
| C、(CH3)2CHCH3和CH3CH2CH2CH3 | ||||
| D、乙醇和乙酸 |
已知热化学方程式N2(g)+3H2(g)?2NH3(g)+Q kJ(Q>0),下列说法中,正确的是( )
| A、1mol N2(g)和3mol H2(g)具有的能量之和低于2 mol NH3(g)具有的能量 |
| B、将1mol N2(g)和3mol H2(g)置于一密闭容器中充分反应后放出Q kJ的热量 |
| C、升高温度,平衡向逆反应方向移动,上述热化学方程式中的Q值减小 |
| D、将一定量N2(g)和H2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有3mol H2被氧化 |
下列反应的离子方程式正确的是( )
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ | ||
| B、石灰乳与Na2CO3溶液混合:Ca(OH)2+CO32-=CaCO3↓+2OH- | ||
| C、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ | ||
D、氢氧化钡溶液与稀硫酸反应:Ba2++S
|
科学家对未发现的第114号元素很感兴趣,预测它有良好的力学、光学、电学性质,将它命名为“类铅”.以下对“类铅”的叙述不正确的是( )
| A、最外层有6个电子 |
| B、是金属 |
| C、主要化合价为+2,+4价 |
| D、最高价氧化物有较强氧化性 |