题目内容
10.以NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 常温常压32g O2 含2NA个原子 | |
| B. | 标准状况下11.2L H2O 含有的原子数目为1.5NA | |
| C. | 1mol的Cl- 含有NA个电子 | |
| D. | 0.5mol/L的NaCl 溶液中Cl-的个数为0.5 NA |
分析 A.氧气是由氧原子构成,依据n=$\frac{m}{M}$计算;
B.气体摩尔体积使用对象为气体;
C.1个氯离子含有18个电子;
D.溶液体积未知.
解答 解:A.常温常压32g O2 含氧原子个数为:$\frac{32g}{16g/mol}$×2×NA=2NA,故A正确;
B.标况下水是液体,不能使用气体摩尔体积,故B错误;
C.1mol的Cl- 含有18NA个电子,故C错误;
D.溶液体积未知,无法计算氯离子个数,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积使用条件和对象是解题关键,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
1.在配制一定物质的量浓度的NaOH溶液时,下列原因会造成所配溶液浓度偏高的是( )
| A. | 称量NaOH固体时动作过于缓慢 | B. | 向容量瓶中加水定容时俯视 | ||
| C. | 有少量NaOH溶液残留在烧杯里 | D. | 称量时误用“左码右物” |
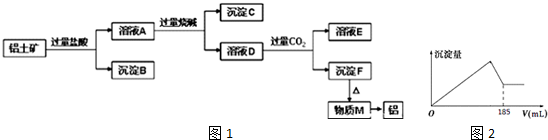
18. 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
Ⅰ.废液组成:
Ⅱ.处理方案:
步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2.
此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是产生大量的CO2不利于工业生产.
步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤.
①Mn2+反应生成MnO2同时放出CO2,写出此反应的离子方程式:Mn2++ClO-+CO32-=MnO2↓+Cl-+CO2↑.
②Co2+反应生成Co(OH)3沉淀同时放出CO2,写出此反应的离子方程式:2Co2++ClO-+2CO32-+3H2O=2Co(OH)3↓+Cl-+2CO2↑;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式:Co2++Ni(OH)3=Co(OH)3↓+Ni2+.
③此步骤中必须控制好NaClO溶液的用量,其原因可能是Mn2+,Co2+沉淀完全而Ni2+不被沉淀.
步骤3:回收镍
以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是:产生大量氢气.
②电解的最佳pH范围是:C (填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.
 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.Ⅰ.废液组成:
| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g•L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2.
此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是产生大量的CO2不利于工业生产.
步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤.
①Mn2+反应生成MnO2同时放出CO2,写出此反应的离子方程式:Mn2++ClO-+CO32-=MnO2↓+Cl-+CO2↑.
②Co2+反应生成Co(OH)3沉淀同时放出CO2,写出此反应的离子方程式:2Co2++ClO-+2CO32-+3H2O=2Co(OH)3↓+Cl-+2CO2↑;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式:Co2++Ni(OH)3=Co(OH)3↓+Ni2+.
③此步骤中必须控制好NaClO溶液的用量,其原因可能是Mn2+,Co2+沉淀完全而Ni2+不被沉淀.
步骤3:回收镍
以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是:产生大量氢气.
②电解的最佳pH范围是:C (填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.
15.下列有关离子的检验方法和判断正确的是( )
| A. | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸,沉淀不溶解,该溶液一定含有SO42- | |
| B. | 向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色,该溶液一定含有Fe2+ | |
| C. | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,该溶液一定含有CO32- | |
| D. | 向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,该溶液一定含有NH4+ |
20.利用如图进行实验,下列实验结果不能说明结论的是( )
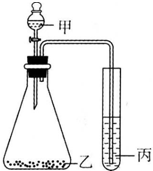

| A. | 甲-盐酸,乙-石灰石,丙-硅酸钠溶液,证明酸性:盐酸>H2CO3>H2SiO3 | |
| B. | 甲-盐酸,乙-亚硫酸钠,丙-溴水,证明还原性:HCI>SO2>HBr | |
| C. | 甲-浓盐酸,乙-高锰酸钾,丙-溴化钾,证明氧化性:KMnO4>Cl2>Br2 | |
| D. | 甲-氯化铵饱和溶液,乙-烧碱,丙-氯化铝,证明碱性:NaOH>NH3•H2O>Al(OH)3 |
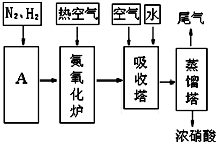
 CO+3H2.
CO+3H2.
 水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:
水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为: