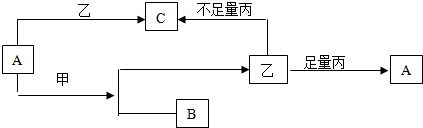
题目内容
NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、常温下的新制氯水中,若含有Cl-的数目为NA,则其中含有ClO-的数目必定是NA |
| B、一定条件下,1.0mol氯气与足量铁完全反应转移的电子数为2NA |
| C、常温常压下,14g氯气所含共用电子对数目为3NA |
| D、0℃、101kpa下,22.4L氯气含质子的数目为4NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氯气与水反应生成氯化氢和次氯酸,次氯酸为弱电解质,溶液中部分电离出次氯酸根离子;
B.1mol氯气与铁反应生成氯化铁,得到2mol电子;
C.氯气分子中含有1对共用电子对,14g氯气的物质的量为
=
mol;
D.标况下22.4L氯气的物质的量为1mol,含有34mol质子.
B.1mol氯气与铁反应生成氯化铁,得到2mol电子;
C.氯气分子中含有1对共用电子对,14g氯气的物质的量为
| 14g |
| 71g/mol |
| 14 |
| 71 |
D.标况下22.4L氯气的物质的量为1mol,含有34mol质子.
解答:
解:A.常温下的新制氯水中,次氯酸为弱电解质,只能部分电离出次氯酸根离子,若含有Cl-的数目为NA,则其中含有ClO-的数目必定小于NA,故A错误;
B.1mol氯气与铁完全反应生成氯化铁,转移了2mol电子,反应转移的电子数为2NA,故B正确;
C.14g氯气的物质的量为
=
mol,含有共用电子对的物质的量为
mol,所含共用电子对数目为
NA,故C错误;
D.0℃、101kpa下为标况下,标况下22.4L氯气的物质的量为1mol,1mol氯气含有34mol质子,含质子的数目为34NA,故D错误;
故选B.
B.1mol氯气与铁完全反应生成氯化铁,转移了2mol电子,反应转移的电子数为2NA,故B正确;
C.14g氯气的物质的量为
| 14g |
| 71g/mol |
| 14 |
| 71 |
| 28 |
| 71 |
| 28 |
| 71 |
D.0℃、101kpa下为标况下,标况下22.4L氯气的物质的量为1mol,1mol氯气含有34mol质子,含质子的数目为34NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,选项A为易错点,注意氯气与水的反应生成的次氯酸为弱电解质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
21世纪化学的最新定义为“化学是一门创造新物质的科学”.下列有关说法不正确的是( )
| A、利用人工光合成反应,探究将二氧化碳转化为碳氢化合物作燃料,属于低碳技术 |
| B、开发安全、高效、低毒及低残留的新型农药 |
| C、加大稀土资源的开采和出口,制造更多高新产品,保证经济快速发展 |
| D、制备物质时探究化学反应中高选择性、转化率和原子利用率,属于“绿色”的生产工艺 |
NA代表阿伏加德罗常数,以下说法正确的是( )
| A、常温常压下1mol N02气体与水反应生成NA个N03-离子 |
| B、在1L 0.2mol/L的硫酸铁溶液中含有的Fe3+数为0.4NA |
| C、标准状况下,3.36L丁烷中含有的非极性键数为0.6NA |
| D、1mol KHSO4熔融态中含有离子总数为2NA |
短周期元素A、B、C、D的原子序数依次增大.A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,元素D位于第ⅥA族.下列说法正确的是( )
| A、原子半径:D>B>C>A |
| B、元素A、B的氧化物所含化学键的类型完全相同 |
| C、元素B和C的最高价氧化物对应水化物的碱性:B<C |
| D、元素B、C、D的最高价氧化物对应的水化物能相互反应 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、0.1mol/L的NaOH溶液:K+、AlO2-、SO42-、CO32- | ||
| B、0.1mol/LFeCl3溶液:K+、NH4+、I-、SCN- | ||
| C、0.1mol/L的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | ||
D、
|
下列有关实验原理、方法和结论都正确的是( )
| A、向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂 |
| B、向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解 |
| C、pH都为3的酸HA和HB分别与足量Mg反应,HA放出的H2多,说明酸性HA<HB |
| D、淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经开始水解 |
下列各离子浓度的比较,正确的是( )
| A、0.1mol?L-1 CH3COONa溶液中:c(OH-)>c(CH3COOH)+c(H+) |
| B、0.1mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合后溶液显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| C、酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H+) |
| D、1.0L 0.3mol?L-1 NaOH溶液缓慢通入CO2气体至溶液增重8.8g,所得溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) |
下列叙述正确的是( )


| A、雌二醇和睾丸素两种物质的分子组成相差一个CH2,但不属于同系物 |
B、按系统命名法,有机物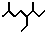 可命名为2,6-二甲基-4-乙基辛烷 可命名为2,6-二甲基-4-乙基辛烷 |
| C、氯气与甲烷在光照射的取代反应历程为:光照下,甲烷分子失去一个氢原子和甲基,甲基再与Cl2碰撞生成CH3Cl和氯自由基(Cl?) |
D、瘦肉精学名克伦特罗,结构如图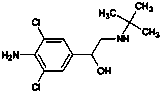 ,可以发生取代、加成、水解、酯化、消去反应 ,可以发生取代、加成、水解、酯化、消去反应 |