题目内容
7.现有1-20号元素A、B、C、D所对应的物质的性质或微粒结构如下:①A的原子M层上有6个电子;
②B 2+与D -具有相同的电子层结构,且可以相互组合形成常见干燥剂;
③元素C的单质常温为双原子气体分子,其氢化物水溶液呈碱性;
④元素D的最高正化合价为+7价.
请回答下列问题:
(1)B的离子与D的离子相互组合形成的干燥剂的化学式是CaCl2,用电子式表示它的形成过程
 .
.(2)元素C与氢元素形成带一个单位正电荷的离子,为10电子微粒,写出该微粒的电子式
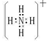 .
.(3)元素A与元素D相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下A的单质和D的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D单质能从A的氢化物水溶液中置换出A单质
d.HD的酸性比HA酸性强.
分析 现有1-20号元素,A原子M层上有6个,则A是S元素;D元素最高正价是+7价,属于第VIIA族元素,且原子序数小于20,F元素没有正化合价,所以D是Cl元素;B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂,氯化钙能作干燥剂,所以B是Ca元素;常温下C单质为双原子分子,其氢化物水溶液呈碱性,则C是N元素,以此解答该题.
解答 解:现有1-20号元素,A原子M层上有6个,则A是S元素;D元素最高正价是+7价,属于第VIIA族元素,且原子序数小于20,F元素没有正化合价,所以D是Cl元素;B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂,氯化钙能作干燥剂,所以B是Ca元素;常温下C单质为双原子分子,其氢化物水溶液呈碱性,则C是N元素,
(1)B的离子与D的离子相互组合形成的干燥剂CaCl2,氯化钙为离子化合物,用电子式表示下列物质的形成过程为 ,
,
故答案为:CaCl2; ;
;
(2)元素C与氢元素形成带一个单位正电荷的离子,该离子是NH4+离子,其电子式为: ,
,
故答案为: ;
;
(3)同一周期元素,元素的非金属性随着原子序数的增大而增大,所以氯元素非金属性大于硫,
a.单质的状态,属于物理性质,不能比较非金属性强弱,故a错误;
b.Cl元素非金属性比S强,故HCl比硫化氢稳定,故b正确;
c.一定条件下氯气能从硫化氢水溶液中置换出S单质,说明氯元素非金属性比S强,故c正确,
d.氢化物溶液酸性强弱不能说明元素非金属性强弱,若非金属性F>Cl,但酸性HF<HCl,故d错误,
故答案为:Cl;bc.
点评 本题考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,正确推断元素是解本题关键,结合物质的性质来分析解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.以下说法不正确的是( )
| A. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| B. | 麦芽糖及其水解产物均能发生银镜反应 | |
| C. | 用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 | |
| D. | 将甘氨酸和丙氨酸混合后缩合最多可形成4种二肽 |
1.关于下列各实验的叙述中,不正确的是( )


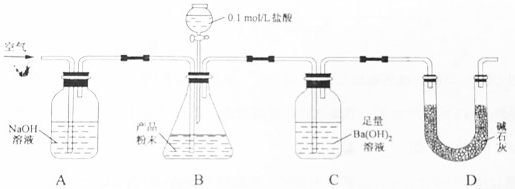
| A. | 装置甲可用于收集H2、NH3、CO2、Cl2等气体 | |
| B. | 装置乙中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| C. | 装置丙可以用于检验装置气密性 | |
| D. | 装置丁中b通入CO2,然后a通入NH3,用于实验室模拟制备NaHCO3 |
2.科学家预测,月球的土壤中吸附着数百万吨${\;}_{2}^{3}$He,100吨${\;}_{2}^{3}$He核聚变释放的能量相当于目前人类一年消耗的能量.下列说法正确的是( )
| A. | ${\;}_{2}^{3}$He的最外层电子数为2,具有较强的金属性 | |
| B. | ${\;}_{2}^{3}$He位于周期表第二周期第ⅡA族 | |
| C. | 其原子核中质子数为2、中子数为1 | |
| D. | 核聚变是通过化学反应而释放出的能量 |
12.以酚酞试液为指示剂,对某新制的NaOH溶液进行中和滴定试验,数据记录如下表:
该新制的NaOH溶液的浓度c (mol/L)合理的是( )
| 待测液 | 消耗标准盐酸(0.1000mol/L)的体积 | |
| ① | 20.00mL NaOH溶液 | V1 mL |
| ② | 20.00mL NaOH溶液+10.00mL水 | V2 mL |
| ③ | 敞口隔夜放置的20.00mL NaOH溶液 | V3 mL |
| A. | c=0.1000×$\frac{{V}_{1}+{V}_{2}+{V}_{3}}{3×20.00}$ | B. | c=0.1000×$\frac{{V}_{1}+{V}_{2}}{2×20.00}$ | ||
| C. | c=0.1000×$\frac{{V}_{1}+{V}_{3}}{2×20.00}$ | D. | c=$\frac{0.1000{V}_{1}}{20.00}$ |
19.下列有基态原子的核外电子在原子轨道上的能量大小关系不正确的是( )
| A. | 5s>4s | B. | 5p>4d | C. | 5d>4f | D. | 5s>4d |
17.生活中处处有化学,下列有关说法正确的是( )
| A. | 饮用矿泉水瓶的主要成分是聚氯乙烯 | |
| B. | 淀粉和纤维素均为天然高分子化合物 | |
| C. | 凡含有食品添加剂的食物均不可食用 | |
| D. | 大米煮成粥后,淀粉就变成了葡萄糖 |