题目内容
高温下,某反应达平衡,平衡常数K=
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应的焓变为正值 | |||
| B、恒温恒容下,增大压强,H2浓度一定减小 | |||
| C、升高温度,逆反应速率减小 | |||
D、该反应化学方程式为CO+H2O
|
考点:化学平衡的影响因素
专题:化学平衡专题
分析:化学平衡常数,是指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,某反应达到平衡,平衡常数K═
,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应.
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
解答:
解:A、恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应,即反应的焓变为正值,故A正确;
B、恒温恒容时,增大氢气的浓度,增大压强,平衡向正反应移动,平衡时氢气的浓度增大,故B错误.
C、升高温度,反应物、生成物的活化分子增多,正、逆反应速率都增大,故C错误;
D、平衡常数K=
,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),故D错误;
故选A.
B、恒温恒容时,增大氢气的浓度,增大压强,平衡向正反应移动,平衡时氢气的浓度增大,故B错误.
C、升高温度,反应物、生成物的活化分子增多,正、逆反应速率都增大,故C错误;
D、平衡常数K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
故选A.
点评:本题考查外界条件对化学平衡的影响、化学平衡常数等,难度中等,注意对化学平衡常数的理解,同一反应,化学计量数不同,平衡常数不同.

练习册系列答案
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
常温下,纯水中存在电离平衡:H2O?H++OH-.欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是( )
| A、FeCl3 |
| B、H2SO4 |
| C、NaHCO3 |
| D、NaOH |
25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
| A、2H2(g)+O2(g)═2H2O(1)△H=-285.8kJ/mol | ||
| B、2H2(g)+O2(g)═2H2O(1)△H=+571.6kJ/mol | ||
| C、2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | ||
D、H2(g)+
|
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A、甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 |
| B、苯与硝酸发生反应生成硝基苯,甲苯与硝酸反应生成三硝基甲苯 |
| C、乙烯能发生加成反应,而乙烷不能发生加成反应 |
| D、苯酚中的羟基氢能与NaOH溶液反应,而醇羟基氢不能与NaOH溶液反应 |
下列有关实验室一般事故的预防和处理方法正确的是( )
| A、燃着的酒精灯打翻失火,应立即用水浇灭 |
| B、为了使过滤速率加快,可用玻棒在过滤器中轻轻搅拌,加速液体流动 |
| C、蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却 |
| D、皮肤上沾有少量浓硫酸,可立即用大量水冲洗 |
化学与生活密切相关.下列叙述错误的是( )
| A、氧化铁在涂料工业中用作红色防锈颜料 |
| B、铝制餐具不宜用来长时间存放酸性、碱性食物 |
| C、硅胶可用作袋装食品、瓶装药品等的干燥剂 |
| D、二氧化硫具有漂白性,可以用于食品增白 |
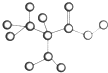 如图是某种只含有C、H、O、N的有机物简易球棍模型.请回答下列各题.
如图是某种只含有C、H、O、N的有机物简易球棍模型.请回答下列各题.