题目内容
在密闭容器中城有氢气、氧气、氯气的混合气体通过电火花点燃,三种气体恰好完全反应,冷却至室温后所得盐酸中的氯化氢的质量分数为25.26%,则容器中的原有氢气氧气预期的物质量之比是多少?
考点:有关混合物反应的计算
专题:计算题
分析:发生反应H2+Cl2
2HCl、2H2+O2
2H2O,恰好完全反应,设生成HCl的物质的量为n1,生成H2O的物质的量为n2,根据质量分数列方程确定n1、n2的关系,根据方程式可知n(H2)=
n(HCl)+n(H2O),n(O2)=
n(H2O),在相同状况下,气体的物质的量之比等于其体积比,据此解答.
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
解答:
解:发生反应H2+Cl2
2HCl、2H2+O2
2H2O,
恰好完全反应,设生成HCl的物质的量为n1,生成H2O的物质的量为n2,则:
×100%=25.26%
整理得,n1:n2=1:6,
令n1=1mol,n2=6mol,根据方程式可知n(H2)=
n(HCl)+n(H2O)=0.5mol+6mol=6.5mol,n(O2)=
n(H2O)=3mol,所以,n(H2):n(O2)=6.5mol:3mol=13:6;
答:容器中的原有氢气氧气预期的物质量之比是13:6.
| ||
| ||
恰好完全反应,设生成HCl的物质的量为n1,生成H2O的物质的量为n2,则:
| 36.5n1 |
| 36.5n1+18n2 |
整理得,n1:n2=1:6,
令n1=1mol,n2=6mol,根据方程式可知n(H2)=
| 1 |
| 2 |
| 1 |
| 2 |
答:容器中的原有氢气氧气预期的物质量之比是13:6.
点评:本题考查混合物的有关计算,根据质量分数确定氯化氢与水的物质的量关系是关键,难度中等,注意利用赋值法简化计算.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4LH2O含有的分子数为1 NA |
| B、32克氧气所含原子数目为4 NA |
| C、1 mol Ca变成Ca2+时失去的电子数为2NA |
| D、1 L 0.1mol?L-1 Na2SO4溶液中有0.1 NA个Na+ |
将11.9gMg、Al、Fe组成的合金溶于足量的NaOH溶液中合金质量减少了2.7g,另取等质量的合金溶于过量稀硝酸中,生成了气体NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全沉淀,其质量为27.2g,则生成气体的体积为(标准状况下)( )
| A、6.72L | B、4.48L |
| C、3.36L | D、无法确定 |
A、B、C三种物质在一定条件下满足如下转化关系  ,则B不可能是( )
,则B不可能是( )
 ,则B不可能是( )
,则B不可能是( )| A、CO |
| B、Na |
| C、S |
| D、CH3COOC2H5 |
下列说法正确的是( )
| A、糖类、油脂、蛋白质完全燃烧只生成CO2 和H2O |
| B、丁烷(C4H10)和二氯甲烷都存在同分异构体 |
| C、向溴水中加入苯,振荡静置后观察下层几乎无色 |
| D、汽油、柴油、植物油都是碳氢化合物 |


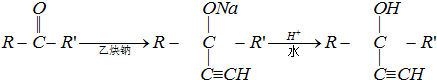
 (碳碳双键)在一定条件下与氧化剂作用,如:
(碳碳双键)在一定条件下与氧化剂作用,如:
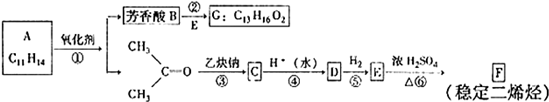
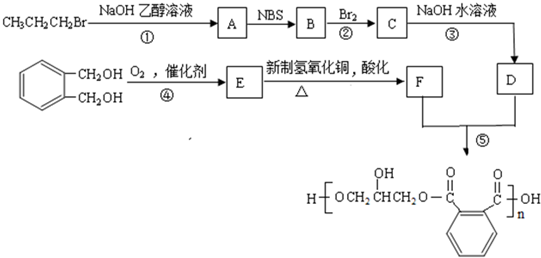
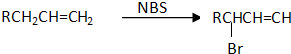
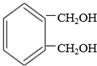 互为同分异构体的结构简式
互为同分异构体的结构简式