题目内容
在一定条件下,向2L密闭容器中充入3mol X(g)和1mol Y(g)进行反应:2X(g)+Y(g)?3Z(g)+2W(g),某时刻测定产物的浓度,不可能的是( )
| A、Z=0.75mol/L |
| B、Z=1mol/L |
| C、W=1mol/L |
| D、Z=0.8mol/L |
考点:化学反应的可逆性
专题:化学平衡专题
分析:开始只投入X、Y,故反应向正反应进行,假定反应物可以完全转化,由X、Y的化学计量数可知,X有剩余,故假设Y完全反应,计算各物质的浓度,由于可逆反应反应物不能完全反应,对于反应物为极小值,对于生成物为极大值,据此判断.
解答:
解:X的起始浓度为
=1.5mol/L,Y的起始浓度为
=0.5mol/L,假设Y完全反应,则各物质的浓度变化量为:
2X(g)+Y(g)?3Z(g)+2W(g)
初始:1.5 mol/L 0.5mol/L
假设Y完全反应 0.5mol/L 1.5mol/L 1mol/L
由于可逆反应反应物不能完全反应,则:0.5mol/L<c(X)<1.5mol/L,
0<c(Y)<0.5mol/L,0<c(Z)<1.5mol/L,0<c(W)<1mol/L,W=1mol/L不可能,
故选C.
| 3mol |
| 2L |
| 1mol |
| 2L |
2X(g)+Y(g)?3Z(g)+2W(g)
初始:1.5 mol/L 0.5mol/L
假设Y完全反应 0.5mol/L 1.5mol/L 1mol/L
由于可逆反应反应物不能完全反应,则:0.5mol/L<c(X)<1.5mol/L,
0<c(Y)<0.5mol/L,0<c(Z)<1.5mol/L,0<c(W)<1mol/L,W=1mol/L不可能,
故选C.
点评:本题考查可逆反应的特征,题目难度不大,注意可逆反应的不完全性,利用极限法进行判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
今有一种固体化合物,本身不导电,但在熔融状态下或溶于水时能够电离.下列说法中正确的是( )
| A、该物质一定为电解质 |
| B、该物质可能为非电解质 |
| C、该物质一定是氯化钠 |
| D、该物质一定是氢氧化钠 |
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)?2Z(g)+W(s)-Q,下列叙述中,正确的是( )
| A、反应过程中,气体的密度始终不变 |
| B、当容器中气体压强不变时,反应达到平衡 |
| C、升高温度,v(正)增大、v(逆)减小,平衡向正反应方向移动 |
| D、当2v正(X)=v逆(Z)时,反应达平衡 |
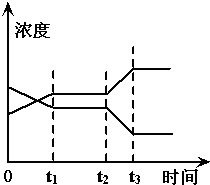 现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )| A、增大压强 |
| B、使用了催化剂 |
| C、升高温度 |
| D、减小了X或Y的浓度 |
下列说法中不正确的是( )
| A、反应是放热还是吸热要由反应物和生成物所具有的总能量来决定 |
| B、需要加热才能发生的反应可能是吸热反应也可能是放热反应 |
| C、放热的反应在常温下一定很容易发生 |
| D、反应热可用量热计测量 |
关于H2O2说法正确的是(NA代表阿伏加德罗常数)( )
| A、摩尔质量为34 g/mol |
| B、每个H2O2分子含2NA个氧原子 |
| C、2 mol H2O2含2 g氢元素 |
| D、H2O2分子中H、O原子个数比为1:16 |