题目内容
18.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的最高价氧化物对应水化物与⑨的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-=AlO2-+H2O.
(4)用电子式表示元素⑨与⑥的化合物的形成过程:
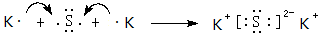 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
分析 由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
(1)稀有气体化学性质最不活泼;
(2)最高价氧化物的水化物中,酸性最强的化合物的分子式为HClO4;同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强;
(3)氢氧化铝属于两性氢氧化物,⑨的最高价氧化物对应水化物为氢氧化钾,与氢氧化铝反应发生偏铝酸钾与水;
(4)⑨和⑥形成的离子化合物为K2S,由钾离子与硫离子构成,用K原子、S原子表示其形成过程.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,故答案为:Ar;
(2)最高价氧化物的水化物中,酸性最强的化合物的分子式为HClO4;上述元素中K的金属性最强,故碱性最强的为KOH,故答案为:HClO4;KOH;
(3)Al(OH)3属于两性氢氧化物,则最高价氧化物是两性氧化物的元素是Al,⑨的最高价氧化物对应水化物为氢氧化钾,与氢氧化铝反应发生偏铝酸钾与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+H2O,
故答案为:Al;Al(OH)3+OH-=AlO2-+H2O;
(4)⑨和⑥形成的离子化合物为K2S,由钾离子与硫离子构成,用K原子、S原子表示其形成过程为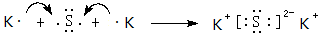 ,
,
故答案为: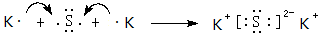 ;离子.
;离子.
点评 本题考查元素周期表与元素周期律的综合应用,难度不大,需要学生熟练掌握周期表的结构、熟记元素符号,注意理解电子式表示物质或化学键的形成.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
9.半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)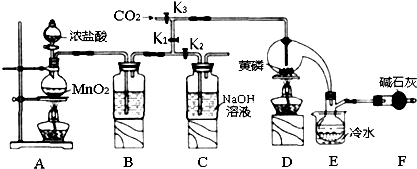
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成 H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见下表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)装置F的名称是球形干燥管,其中装的碱石灰的作用是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O;
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定;
③重复②、③操作,平均消耗Na2S2O3溶液8.40ml.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应,根据上述数据,该产品中PCl3的质量分数为79.75%.

已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成 H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)装置F的名称是球形干燥管,其中装的碱石灰的作用是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O;
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定;
③重复②、③操作,平均消耗Na2S2O3溶液8.40ml.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应,根据上述数据,该产品中PCl3的质量分数为79.75%.
6.下列有机物的命名正确的是( )
| A. |  3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 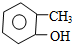 邻甲基苯酚 邻甲基苯酚 | |
| D. | 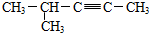 2-甲基-3-戊炔 2-甲基-3-戊炔 |
3.下列叙述中正确的是( )
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 含氧酸可作氧化剂而无氧酸则不能 | |
| C. | 金属原子失电子数越多,其还原性越强 | |
| D. | 金属单质在反应中只作还原剂 |
7.下列实验操作先后顺序正确的是( )
| A. | 先装好药品,再检查装置的气密性 | |
| B. | 先用双手握紧试管,再将导管插入水中检查装置气密性 | |
| C. | 结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管 | |
| D. | 稀释硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
8.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
①2Fe2++H2O2+2H+=2Fe3++2H2O
②2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法不正确的是( )
①2Fe2++H2O2+2H+=2Fe3++2H2O
②2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法不正确的是( )
| A. | H2O2在反应①中作氧化剂,在反应②中作还原剂 | |
| B. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| C. | 在H2O2分解过程中,Fe2+起到催化剂的作用 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |