题目内容
6.下列有机物的命名正确的是( )| A. |  3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 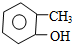 邻甲基苯酚 邻甲基苯酚 | |
| D. | 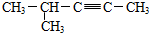 2-甲基-3-戊炔 2-甲基-3-戊炔 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A. 为烷烃,选取最长碳链,含6个碳原子,离取代基近的一端编号得到名称为:3、4-二甲基己烷,故A错误;
为烷烃,选取最长碳链,含6个碳原子,离取代基近的一端编号得到名称为:3、4-二甲基己烷,故A错误;
B.(CH3)3CCH2CH(C2H5)CH3 烷烃中最长碳链含6个碳,离取代基近的一端编号得到名称为:2,2,4-三甲基己烷,故B错误;
C. 苯环上含酚羟基,甲基位于邻位得到名称为:邻甲基苯酚,故C正确;
苯环上含酚羟基,甲基位于邻位得到名称为:邻甲基苯酚,故C正确;
D.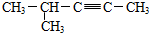 选取含碳碳三键的最长碳链为主碳链,离碳碳三键近的一端编号,得到名称为:4-甲基-2-戊炔,故D错误;
选取含碳碳三键的最长碳链为主碳链,离碳碳三键近的一端编号,得到名称为:4-甲基-2-戊炔,故D错误;
故选C.
点评 本题考查了有机物的命名知识,题目难度不大,一般要求了解烷烃的命名、苯的同系物的命名及简单的烃的衍生物的命名.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
14.青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药.已知:乙醚沸点为35℃.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法.乙醚浸取法的主要工艺为如图1:
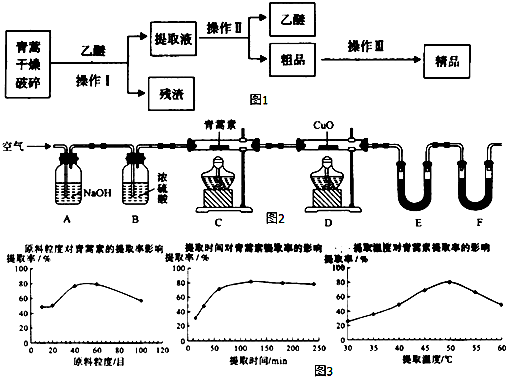
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I需要的玻璃仪器主要有:烧杯、漏斗、玻璃棒,为加速操作I的进行,最好采用抽滤或减压过滤的方法,操作Ⅱ的名称是蒸馏.
(3)操作Ⅲ的主要过程可能是B(填字母).
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用如图2实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算.
①装置E中盛放的物质是CaCl2或P2O5,装置F中盛放的物质是碱石灰.
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是在装置F后连接一个防止空气中的CO₂和水蒸气进入F的装置.
③用合理改进后的装置进行试验,称得:
则测得青蒿素的最简式是C15H22O5.
(5)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相同的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
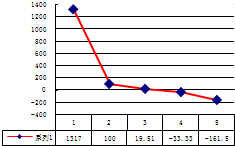
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如图3所示,由图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为B.
A.80目、100分钟、50℃B.60目、120分钟、50℃C.60目、120分钟、55℃

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I需要的玻璃仪器主要有:烧杯、漏斗、玻璃棒,为加速操作I的进行,最好采用抽滤或减压过滤的方法,操作Ⅱ的名称是蒸馏.
(3)操作Ⅲ的主要过程可能是B(填字母).
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用如图2实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算.
①装置E中盛放的物质是CaCl2或P2O5,装置F中盛放的物质是碱石灰.
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是在装置F后连接一个防止空气中的CO₂和水蒸气进入F的装置.
③用合理改进后的装置进行试验,称得:
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(5)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相同的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如图3所示,由图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为B.
A.80目、100分钟、50℃B.60目、120分钟、50℃C.60目、120分钟、55℃
1.肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气.已知:N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ/mol,N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=+1 076.7 kJ/mol | |
| D. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-538.35kJ/mol |
18.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的最高价氧化物对应水化物与⑨的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-=AlO2-+H2O.
(4)用电子式表示元素⑨与⑥的化合物的形成过程: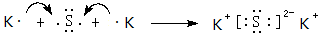 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的最高价氧化物对应水化物与⑨的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-=AlO2-+H2O.
(4)用电子式表示元素⑨与⑥的化合物的形成过程:
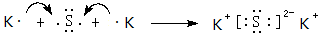 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. 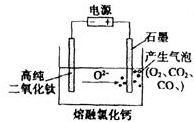 如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛.阴极的电极反应式为TiO2+4e-→Ti+2O2-,石墨电极的质量是否发生变化是 (填“是”或“否”).
如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛.阴极的电极反应式为TiO2+4e-→Ti+2O2-,石墨电极的质量是否发生变化是 (填“是”或“否”).

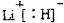 .
.
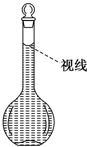 用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶