题目内容
10.气体X可能含有NH3、Cl2、H2S、HBr、CO2中的一种或几种.已知X通入硝酸银溶液时产生淡黄色、不溶于稀硝酸的沉淀,若将X通入澄清石灰水中没有沉淀,则下列关于气体X的成分的说法中正确的是( )| A. | 一定含有溴化氢,不一定含有二氧化碳 | |
| B. | 一定不含二氧化碳 | |
| C. | 一定不含氨气和硫化氢 | |
| D. | 可能含有二氧化碳和氯气 |
分析 Cl2与NH3、H2S、HBr均反应不能共存,NH3、HBr反应不能共存,X通入硝酸银溶液时产生淡黄色、不溶于稀硝酸的沉淀,沉淀为AgBr,可知一定含HBr,则不含NH3、Cl2,H2S和硝酸银生成黑色硫化银沉淀,也一定不存在H2S,若将X通入澄清石灰水中没有沉淀,因强酸溶液可溶解碳酸钙,则不能确定是否含CO2,以此来解答.
解答 解:X通入硝酸银溶液时产生淡黄色、不溶于稀硝酸的沉淀,沉淀为AgBr,可知一定含HBr,则不含H2S、NH3、Cl2,
若将X通入澄清石灰水中没有沉淀,因强酸溶液可溶解碳酸钙,则不能确定是否含CO2,
A.由上述分析可知,一定含有溴化氢,不能确定是否含有二氧化碳,故A错误;
B.不能确定是否含有二氧化碳,故B错误;
C.由上述分析可知,一定不含氨气和硫化氢,故C正确;
D.不能确定是否含有二氧化碳,一定不存在氯气,故D错误;
故选C.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,淡黄色沉淀为推断的突破口,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
20.常温下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+,下列说法正确的是( )
| A. | 向10mLpH=5的CH3COOH溶液中加水至10L,最后溶液pH在7和8之间 | |
| B. | 加入少量CH3COONa固体,平衡向左移动,c(CH3COO-)下降 | |
| C. | 加入少量NaOH固体(忽略溶解热效应),平衡向右移动,水的电离程度也随之增大 | |
| D. | 向10mLpH=5的CH3COOH溶液中加入等体积,等浓度的盐酸,混合溶液的c(H+)不变 |
1.已知反应:aA(g)+bB(g)?cC(g),若其他条件不变时,改变某一条件对其平衡的影响的几种情况的图象(图中p表示压强,r表示温度,n表示物质的量,a表示平衡转化率,横坐标均为时间)如下.下列判断正确的是( )
| A. | 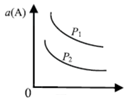 图:p1>p2,则此反应只能在高温下自发进行 | |
| B. |  图:此反应的△H<0,且T1<T2 | |
| C. |  图:表示t1时刻一定是使用催化剂对反应速率的影响 | |
| D. |  图:表示t1时刻增大B的浓度对反应速率的影响 |
18.反应:4NH3+5O2═4NO+6H2O,下列关系正确的是( )
| A. | $\frac{4}{5}$ v(NH3)=v(O2) | B. | $\frac{4}{5}$ v(O2)=v(NO) | C. | $\frac{5}{6}$ v(O2)=v(H2O) | D. | $\frac{2}{3}$ v(NH3)=v(H2O) |
5.NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,2g H2中含有的氢原子数为2NA | |
| B. | 标准状况下,22.4L水中含有的分子数为NA | |
| C. | 1L 0.1mol/L NaCO3溶液中含有的钠离子数为NA | |
| D. | 将1mol Cl2通入足量FeCl2溶液中充分反应,转移电子数为NA |
15.将10%的硫酸溶液与90%的硫酸溶液等体积混合,混合溶液的质量分数是( )
| A. | 等于50% | B. | >50% | C. | <50% | D. | 无法判断 |
19.反应4NH3(g)+5O2(g)→4NO(g)+6H2O(g),在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则反应的平均速度是( )
| A. | v(O2)=0.0125mol/(L•s) | B. | v(NO)=0.06mol/(L•s) | ||
| C. | v(NH3)=0.002mol/(L•s) | D. | v(H2O)=0.0003mol/(L•s) |