题目内容
工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯
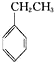 (g)+CO2(g)?
(g)+CO2(g)?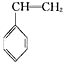 (g)+CO(g)+H2O(g)△H=-166kJ?mol-1
(g)+CO(g)+H2O(g)△H=-166kJ?mol-1
(1)①乙苯与CO2反应的平衡常数表达式为:K= .
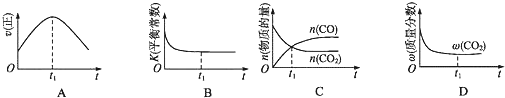
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号).
(2)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol?L-1和3.0mol?L-1,其中实验Ⅰ在T1℃,0.3MPa,而实验Ⅱ、Ⅲ分别改变了实验其他条件;乙苯的浓度随时间的变化如图1所示.
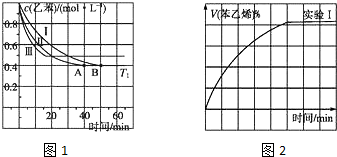
①实验Ⅰ乙苯在0~50min时的反应速率为 .
②实验Ⅱ可能改变的条件是 .
③图2是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(3)若实验Ⅰ中将乙苯的起始浓度改为1.2mol?L-1,其他条件不变,乙苯的转化率将 (填“增大”“减小”或“不变”),计算此时平衡常数为 .
 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)△H=-166kJ?mol-1
(g)+CO(g)+H2O(g)△H=-166kJ?mol-1(1)①乙苯与CO2反应的平衡常数表达式为:K=
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是

(2)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol?L-1和3.0mol?L-1,其中实验Ⅰ在T1℃,0.3MPa,而实验Ⅱ、Ⅲ分别改变了实验其他条件;乙苯的浓度随时间的变化如图1所示.

①实验Ⅰ乙苯在0~50min时的反应速率为
②实验Ⅱ可能改变的条件是
③图2是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(3)若实验Ⅰ中将乙苯的起始浓度改为1.2mol?L-1,其他条件不变,乙苯的转化率将
考点:化学平衡常数的含义,化学平衡的影响因素,产物的百分含量随浓度、时间的变化曲线,化学平衡的计算
专题:化学平衡专题
分析:(1)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,结合方程式分析;
②a、到达平衡后正、逆速率相等,不再变化;
b、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
c、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
d、到达平衡后各组分的含量不发生变化;
(2)①根据图I中乙苯的浓度变化,求出反应速率;
②根据图I中实验Ⅱ改变条件平衡不移动,反应速率增大;
③图1可知曲线Ⅲ乙苯的物质的量浓度较大,所以苯乙烯的体积分数就小,而且Ⅲ达平衡时间短,然后作图;
(3)根据加入乙苯引起的浓度增大量与平衡移动引起的浓度减小量的相对关系分析;温度不变平衡常数不变.
②a、到达平衡后正、逆速率相等,不再变化;
b、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
c、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
d、到达平衡后各组分的含量不发生变化;
(2)①根据图I中乙苯的浓度变化,求出反应速率;
②根据图I中实验Ⅱ改变条件平衡不移动,反应速率增大;
③图1可知曲线Ⅲ乙苯的物质的量浓度较大,所以苯乙烯的体积分数就小,而且Ⅲ达平衡时间短,然后作图;
(3)根据加入乙苯引起的浓度增大量与平衡移动引起的浓度减小量的相对关系分析;温度不变平衡常数不变.
解答:
解:(1)①乙苯与CO2反应的平衡常数表达式为:K=
,故答案为:
;
②A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确,
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确;
故答案为:BD;
(2)①根据图I中可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,
则其反应速率为
=
=0.012mol/(L?min);
故答案为:0.012mol/(L?min);
②根据图I中实验Ⅱ改变条件平衡不移动,而反应速率增大,所以改变的条件是加催化剂,
故答案为:加催化剂;
③图1可知曲线Ⅲ乙苯的物质的量浓度较大,所以苯乙烯的体积分数就小,而且Ⅲ达平衡时间短,然后作为: ,故答案为:
,故答案为: ;
;
(3)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,平衡正移,由于二氧化碳的初始浓度没变,平衡移动引起的乙苯的浓度的减小量小于加入的乙苯引起的浓度增加量,所以乙苯的转化率减小;
由 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g)
初起量:1.0 3.0 0 0 0
变化量:0.6 0.6 0.6 0.6 0.6
平衡量:0.4 2.4 0.6 0.6 0.6
所以平衡常数为:K=
=0.225,
故答案为:减小;0.225.
| c(C6H5CH=CH2)?c(CO)?c(H2O) |
| c(C6H5CH2CH3)?c(CO2) |
| c(C6H5CH=CH2)?c(CO)?c(H2O) |
| c(C6H5CH2CH3)?c(CO2) |
②A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确,
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确;
故答案为:BD;
(2)①根据图I中可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,
则其反应速率为
| △c |
| t |
| 0.6mol/L |
| 50min |
故答案为:0.012mol/(L?min);
②根据图I中实验Ⅱ改变条件平衡不移动,而反应速率增大,所以改变的条件是加催化剂,
故答案为:加催化剂;
③图1可知曲线Ⅲ乙苯的物质的量浓度较大,所以苯乙烯的体积分数就小,而且Ⅲ达平衡时间短,然后作为:
 ,故答案为:
,故答案为: ;
;(3)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,平衡正移,由于二氧化碳的初始浓度没变,平衡移动引起的乙苯的浓度的减小量小于加入的乙苯引起的浓度增加量,所以乙苯的转化率减小;
由
 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g)初起量:1.0 3.0 0 0 0
变化量:0.6 0.6 0.6 0.6 0.6
平衡量:0.4 2.4 0.6 0.6 0.6
所以平衡常数为:K=
| 0.6×0.6×0.6 |
| 0.4×2.4 |
故答案为:减小;0.225.
点评:本题综合性较大,涉及化学平衡状态的判断、化学平衡常数、化学平衡影响因素、反应速率的计算等,题目涉及的内容较多,侧重于考查学生对知识点的综合应用能力,题目难度中等.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、任何一个能层最多只有s、p、d、f四个能级 |
| B、电子在原子核外的一个空间运动状态称为一个原子轨道 |
| C、氢原子只有一个电子,故氢原子只有一个轨道 |
| D、某元素原子的核外有四个能层,最外能层有1个电子的基态原子共有2种 |
保存下列试剂时,不需使用棕色试剂瓶的是( )
| A、NaHCO3 |
| B、浓硝酸 |
| C、氯水 |
| D、AgBr |
关于0.2mol/L的NaOH溶液,下列说法不正确的是( )
| A、100mL该溶液中含0.8g NaOH |
| B、200mL该溶液与100mL 0.2mol/L的硫酸溶液反应形成中性溶液 |
| C、100mL该溶液中约含0.02mol×6.02×1023mol-1个Na+ |
| D、配制含1L水的该溶液,需NaOH的质量为8g |
近年来,人类生产、生活所产生的污染,如机动车、燃煤、工业等排放的尾气,使灰霾天气逐渐增多.灰霾粒子比较小,平均直径大约在1000~2000nm左右.下列有关说法正确的是( )
| A、灰霾是一种分散系 |
| B、灰霾能发生丁达尔现象 |
| C、灰霾形成的是非常稳定的体系 |
| D、戴口罩不能阻止呼入灰霾粒子 |

 2008年北京奥运会出现了中国自己生产的燃料电池汽车,作为马拉松领跑车和电视拍摄车,该车装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示
2008年北京奥运会出现了中国自己生产的燃料电池汽车,作为马拉松领跑车和电视拍摄车,该车装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.