题目内容
4.实验室里常用的干燥剂有:①固体氢氧化钠 ②五氧化二磷 ③浓硫酸 ④无水氯化钙 ⑤碱石灰(主要成分是氢氧化钠、氧化钙)等 ⑥生石灰 ⑦变色硅胶[主要成分是二氧化硅,在其中掺人少量的无水氯化钴(CoC12)作指示剂].(1)上述①、④、⑥三种干燥剂中,其主要化学成分所属的类别依次为B、C、D.(填序号)
A.酸 B.碱 C.盐 D.氧化物
(2)硅胶中无水氯化钴(CoC12)呈蓝色,吸水后变为粉红色的CoC12•6H2O,该变化过程属于化学(填“物理”或“化学”)变化.
(3)生石灰常用作食品干燥剂,久置后易失去干燥能力,其原因为CaO+H2O=Ca(OH)2(用化学方程式表示).
(4)上述干燥剂中,既可以干燥O2,又可以干燥CO2的是②③④⑦(填序号).
分析 (1)固体氢氧化钠水溶液中电离出的阴离子全部是氢氧根离子属于碱,无水氯化钙是金属阳离子和酸根阴离子构成的盐,生石灰是两种元素组成其中一种是氧元素的化合物为氧化物;
(2)有新物质生成的是化学变化;
(3)氧化钙能与水反应;
(4)既可以干燥O2,又可以干燥CO2的干燥剂应是和氧气、二氧化碳不反应,不能溶解吸收气体的干燥剂,固体氢氧化钠、生石灰、碱石灰是碱性干燥剂不能用来干燥酸性氧化物二氧化碳气体;
解答 解:(1)①固体氢氧化钠属于碱,选B,④无水氯化钙属于盐,选C,⑥生石灰属于氧化物,选D,
故答案为:B,C,D;
(2)无水氯化钴(CoCl2)呈蓝色,吸水后变为粉红色的CoCl2•6H2O,有新物质生成,故答案为:化学;
(3)氧化钙能与水反应:CaO+H2O=Ca(OH)2,故答案为:CaO2+H2O=Ca(OH)2;
(4)①固体氢氧化钠和二氧化碳反应不能用来干燥气体,
②五氧化二磷是酸性干燥剂可以干燥氧气和二氧化碳,
③浓硫酸是酸和二氧化碳、氧气不反应,可以干燥气体,
④无水氯化钙是中性干燥剂,可以干燥二氧化碳和氧气,
⑤碱石灰(主要成分是氢氧化钠、氧化钙)等,可以和二氧化碳反应,不能干燥二氧化碳气体,
⑥生石灰 能和二氧化碳反应不能干燥二氧化碳气体,
⑦变色硅胶[主要成分是二氧化硅,在其中掺人少量的无水氯化钴(CoC12)作指示剂],和氧气、二氧化碳不反应,可以干燥气体,
故答案为:②③④⑦.
点评 本题考查物质的分类和性质,侧重于基础知识的考查,注意把握物质的分类角度和性质,难度不大,学习中注意相关基础知识的积累.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
15. 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )
 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )| A. | 充电时,每生成1mol Al,电解质溶液中会增加7molAlCl4- | |
| B. | 放电时,电解质中的阳离子(EMl+)未发生反应 | |
| C. | 放电时,负极反应方程式为Al+7AlCl4--3e-═4Al2Cl7- | |
| D. | 充电时,Cn为阳极,电极方程式为Cn+AlCl4--e-═Cn[AlCl4] |
12.NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,22.4L CHCl3含氯原子数为3NA | |
| B. | 100mL 1 mol•L-1醋酸溶液中的氢原子数为0.4NA | |
| C. | 常温常压下,11.2g乙烯中共用电子对数为2.4NA | |
| D. | 6.4 g CaC2晶体中所含的离子总数为0.3NA |
19.下列离子方程式与所述事实相符且书写正确的是( )
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 肥皂水能使酚酞试液变红:C17H35COO-+H2O?C17H35COOH+OH- | |
| C. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O | |
| D. | 已知苯甲酸的酸性比碳酸强,向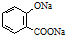 溶液中通入过量CO2: 溶液中通入过量CO2: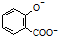 +2CO2+2H2O→ +2CO2+2H2O→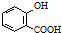 +2HCO3- +2HCO3- |
9.下图所示的四个原电池装置,其中结论正确的是( )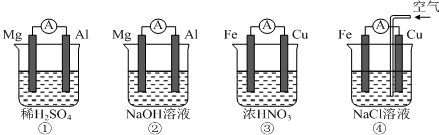

| A. | ①中Mg作负极,电子流向:Mg→稀硫酸→Al | |
| B. | ②中Al作负极,OH?迁移方向:Al→外电路→Mg | |
| C. | ③中Fe作正极,电极反应式:2H++2e?═H2↑ | |
| D. | ④中Cu作正极,电极反应式:O2+4e?+2H2O═4OH? |
16.已知:H2O(g)═H2O(l)△H1=-Q1kJ•mol-1;C2H5OH(g)=C2H5OH(l)△H2=-Q2kJ•mol-1;C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3kJ•mol-1.若23g液体酒精完全燃烧,最后恢复到室温,则放出的热量为( )
| A. | Q1+Q2+Q3 | B. | 1.5Q1-0.5Q2+0.5Q3 | ||
| C. | 0.5Q1-0.5Q2+0.5Q3 | D. | 0.5(Q1+Q2+Q3) |
13.下列开发利用自然资源制取化学品,其途径较合理的是( )
| A. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{高温}{→}$MgO$\stackrel{电解}{→}$Mg | |
| B. | 石油$\stackrel{裂解}{→}$$\stackrel{分馏}{→}$苯、甲苯、二甲苯、酚等 | |
| C. | 铝土矿$\stackrel{NaOH}{→}$$\stackrel{过滤}{→}$$\stackrel{盐酸}{→}$$\stackrel{过滤}{→}$Al(OH)3$\stackrel{灼烧}{→}$Al2O3$\stackrel{电解}{→}$Al | |
| D. | 海洋生物$\stackrel{灼烧}{→}$$\stackrel{浸取}{→}$$\stackrel{Cl_{2}}{→}$$\stackrel{萃取}{→}$$\stackrel{分离提纯}{→}$I2 |
14.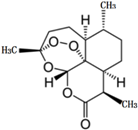 2015年10月,屠呦呦因青蒿素和双氢青蒿素的贡献,荣获2015年诺贝尔生理学或医学奖,成为第一位获得诺贝尔科学奖项的中国本土科学家.青蒿素的化学结构如图所示,下列说法不正确的是( )
2015年10月,屠呦呦因青蒿素和双氢青蒿素的贡献,荣获2015年诺贝尔生理学或医学奖,成为第一位获得诺贝尔科学奖项的中国本土科学家.青蒿素的化学结构如图所示,下列说法不正确的是( )
 2015年10月,屠呦呦因青蒿素和双氢青蒿素的贡献,荣获2015年诺贝尔生理学或医学奖,成为第一位获得诺贝尔科学奖项的中国本土科学家.青蒿素的化学结构如图所示,下列说法不正确的是( )
2015年10月,屠呦呦因青蒿素和双氢青蒿素的贡献,荣获2015年诺贝尔生理学或医学奖,成为第一位获得诺贝尔科学奖项的中国本土科学家.青蒿素的化学结构如图所示,下列说法不正确的是( )| A. | 青蒿素的分子式为C15H21O5 | |
| B. | 由青蒿素分子中所含官能团推测,该物质难溶于水 | |
| C. | 在碱性条件下,青蒿素易发生水解反应 | |
| D. | 青蒿素因具有特殊的过氧基团,易受热和还原性物质的影响而分解 |
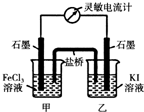 常温下,将FeCl3溶液和KI溶液混合,发生如下反应:2Fe3++2I-?2Fe2++I2
常温下,将FeCl3溶液和KI溶液混合,发生如下反应:2Fe3++2I-?2Fe2++I2