题目内容
汽车的启动电源常用铅蓄电池.其电池反应如下:PbO2+Pb+2H2SO4
2PbSO4+2H2O.当蓄电池放电时,下列叙述中正确的是( )
| 放电 |
| 充电 |
| A.Pb是正极 |
| B.PbO2得电子,被氧化 |
| C.PbO2得电子,被还原 |
| D.电池放电时,溶液酸性增强 |
A.该原电池中,铅失电子发生氧化反应,作负极,故A错误;
B.正极上二氧化铅得电子发生还原反应,被还原,故B错误;
C.正极上二氧化铅得电子发生还原反应,被还原,故C正确;
D.硫酸作反应物生成硫酸铅和水,导致溶液中硫酸的量减少,则酸性减弱,故D错误;
故选C.
B.正极上二氧化铅得电子发生还原反应,被还原,故B错误;
C.正极上二氧化铅得电子发生还原反应,被还原,故C正确;
D.硫酸作反应物生成硫酸铅和水,导致溶液中硫酸的量减少,则酸性减弱,故D错误;
故选C.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
汽车的启动电源常用铅蓄电池.下列叙述正确的是( )
| A、放电时,电子从PbO2一极流入铅板 | B、放电时,负极的电极反应式为:Pb+SO2-4-2e-=PbSO4 | C、充电时,PbO2得到电子,被氧化 | D、放电时,溶液的酸性增强 |
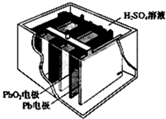 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A、PbO2是电池的负极 | B、放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强 | C、放电时,电子由Pb 极通过导线流向 PbO2 | D、正极的电极反应式为Pb-2e-=Pb2+ |