题目内容
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
(1)判断BaCl2已过量的方法是
(2)第④步中,加入碳酸钠的作用是
(3)若先用盐酸再过滤,将对实验结果产生影响,其原因是
(4)为检验精盐纯度,需配制250mL 0.2mol/L NaCl(精盐)溶液,如图是该同学转移溶液的示意图,其中的错误是
考点:粗盐提纯
专题:实验设计题
分析:(1)根据钡离子能和硫酸根之间反应生成硫酸钡沉淀来检验氯化钡是否过量;
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来;
(3)氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应;
(4)根据容量瓶的使用方法以及移液操作知识来回答.
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来;
(3)氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应;
(4)根据容量瓶的使用方法以及移液操作知识来回答.
解答:
解:(1)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取少量上层清液于试管中,再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来,反应原理是Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,
故答案为:除去Ca2+及过量的Ba2+;
(3)若先用盐酸调pH再过滤,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,将对实验结果产生影响,
故答案为:若过滤前加盐酸,前面所生成的沉淀会被盐酸溶液重新变为离子进入溶液;
(4)向容量瓶中转移液体时,要用玻璃棒来引流,配制一定体积的溶液要选择一定体积的容量瓶,故答案为:移液时未用玻璃棒引流,未采用250mL容量瓶.
故答案为:取少量上层清液于试管中,再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来,反应原理是Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,
故答案为:除去Ca2+及过量的Ba2+;
(3)若先用盐酸调pH再过滤,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,将对实验结果产生影响,
故答案为:若过滤前加盐酸,前面所生成的沉淀会被盐酸溶液重新变为离子进入溶液;
(4)向容量瓶中转移液体时,要用玻璃棒来引流,配制一定体积的溶液要选择一定体积的容量瓶,故答案为:移液时未用玻璃棒引流,未采用250mL容量瓶.
点评:本题为物质的分离和提纯的方法和基本操作的综合应用题,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
相关题目
用铂电极电解一定浓度的下列物质的水溶液,在电解后的电解液中加适量水,能使溶液浓度恢复到电解前浓度的是( )
| A、NaCl |
| B、Na2CO3 |
| C、CuSO4 |
| D、KBr |
0.4mol CuSO4和0.4mol NaCl溶于水,配成1L溶液,用惰性电极进行电解,当一个电极得到0.3mol Cu时,另一个电极上生成的气体在标准状况下的体积是( )
| A、5.6L |
| B、6.72L |
| C、1.344L |
| D、11.2L |
为鉴别K2CO3和NaHCO3两种白色固体,有四名同学分别设计了下列四种不同的方法,其中不可行的是( )
| A、分别滴加0.1 mol?L-1的盐酸,看气泡产生的快慢 |
| B、分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色沉淀生成 |
| C、分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 |
| D、分别配成溶液,做焰色反应实验,观察火焰的颜色 |
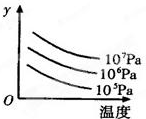 有某可逆反应aA(g)+bB(g)cC(g);△H=Q kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )
有某可逆反应aA(g)+bB(g)cC(g);△H=Q kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )| A、a+b<c时,y轴表示平衡混合气中C的质量分数 |
| B、a+b>c时,y轴表示平衡混合气的平均摩尔质量 |
| C、Q>0时,y轴表示达到平衡时B的转化率 |
| D、Q<0时,y轴表示达到平衡时A的浓度 |
 有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.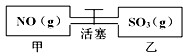 如图,容积相等的甲乙两个容器,通过活塞相连,分别充入NO和SO3且使气体密度相等.打开活塞使气体充分混合,发生反应:SO3(g)+NO(g)?SO2(g)+NO2(g)并达到平衡.反应过程中两容器的温度恒定且相等.则打开活塞前后,容器甲中保持不变的是( )
如图,容积相等的甲乙两个容器,通过活塞相连,分别充入NO和SO3且使气体密度相等.打开活塞使气体充分混合,发生反应:SO3(g)+NO(g)?SO2(g)+NO2(g)并达到平衡.反应过程中两容器的温度恒定且相等.则打开活塞前后,容器甲中保持不变的是( )