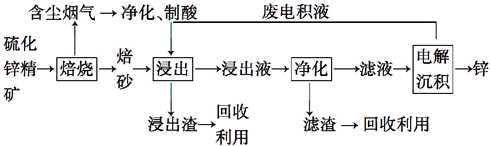
题目内容
13.四氯化锡是一种无色易流动的液体,可用于有机合成中的氯化催化剂.实验室中用Cl2和Sn粉在加热条件下合成SnCl4,实验装置如图所示:(己知SnCl4极易水解,在潮湿的空气中发烟)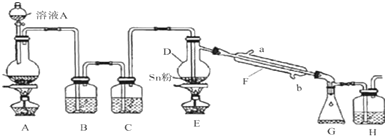
回答下列问题:
(1)装置A中盛装溶液A的仪器名称为分液漏斗,烧瓶中发生反应的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中盛装的溶液为饱和食盐水,装置C中盛装的是浓硫酸,若无此装置,则装置D中可能得到的副产物是SnO2(或Sn(OH)4、H2SnO3、H4SnO4也可).
(3)冷却水从装置Fb(填“a”或“b”)口进入,装置H的作用为吸收尾气,装的溶液为①④(填序号).
①NaOH溶液 ②饱和食盐水 ③浓硫酸 ④浓FeBr2溶液
(4)为减少实验误差,可在装置G和H之间添加连接盛有碱石灰的干燥管(或U形管)(填添加的装置和试剂).
(5)若实验结束时,装置G中收集到74.4g SnCl4,装置A中产生标准状况下13.44L气体,则SnCl4的产率为95.0%.(Sn足量并不计气体损耗.)
分析 工业上常用氯气与金属锡反应制备四氯化锡,D装置烧瓶中含有Sn,则A目的是制取氯气,常用MnO2和浓盐酸在加热条件下制取,发生的反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;浓盐酸具有挥发性,加热促进挥发,水在加热条件下易变成水蒸气,所以生成的氯气中含有HCl、H2O;SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发,为防止D中生成的SnCl4水解和Sn与HCl反应,则B、C要除去HCl、Cl2,用饱和的食盐水除去HCl,用浓硫酸干燥Cl2;G中收集的物质是SnCl4,氯气具有强氧化性,溴化亚铁具有还原性,能吸收氯气,以此解答该题.
解答 解:(1)由装置图可知装置A中盛装溶液A的仪器名称为分液漏斗,MnO2和浓盐酸在加热条件下发生的反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:分液漏斗;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)装置B用于除杂,可盛装饱和食盐水除去氯气中的HCl,若没有装置C,水蒸气会进入装置D中,根据题目信息,生成的SiCl4能与H2O发生反应:SnCl4+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Sn(OH)4+4HCl,加热促进其水解,生成的Sn(OH)4分解生成SnO2,所以可能得到的副产物为SnO2(或Sn(OH)4、H2SnO3、H4SnO4也可),
故答案为:饱和食盐水;SnO2(或Sn(OH)4、H2SnO3、H4SnO4也可);
(3)冷却水应从下进上出,从b口进入F中,可起到充分冷却的作用,装置H用于吸收尾气,可选用NaOH溶液,浓FeBr2溶液等,
故答案为:b;吸收尾气;①④;
(4)SnCl4发生水解,为防止水解,要防止H中的水蒸气进入G装置,所以改进措施为在装置G、H之间连接盛有碱石灰的干燥管(或U形管),
故答案为:连接盛有碱石灰的干燥管(或U形管);
(5)根据反应:Sn+2Cl2$\frac{\underline{\;加热\;}}{\;}$SnCl4,13.44L标准状况下的Cl2体积为0.6mol,理论上可得0.3molSnCl4,其质量=0.3mol×261g/mol=78.3g,故SnCl4的产率=$\frac{74.4g}{78.3g}$×100%=95.0%,故答案为:95.0%.
点评 本题考查物质制备,为高频考点,涉及盐类水解、气体制备和性质、氧化还原反应、化学方程式的计算等知识点,明确实验原理、物质性质、实验基本操作等是解本题关键,知道各个装置作用及可能发生的反应,题目难度中等.


下列说法正确的是( )
| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | B. | 样品CuO的质量一定为4.0g | ||
| C. | 样品中Fe元素的质量为56V/22400g | D. | 样品中Fe元素的质量为2.24 g |
| A. | 114号元素在周期表中第七周期第VIA族,属于金属元素 | |
| B. | 晶体硅熔点高硬度大,可用于制作光导纤维 | |
| C. | 光束通过下列分散系①云,雾 ②墨水③稀豆浆时,均产生丁达尔效应 | |
| D. | 棉,麻,羊毛及合成纤维完全燃烧都只生成CO2和H2O |
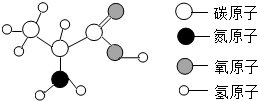 蛋白质是由多种氨基酸构成的极为复杂的化合物,相对分子质量从几万到几百万.如图为丙氨酸分子结构模型,下列关于丙氨酸的说法正确的是( )
蛋白质是由多种氨基酸构成的极为复杂的化合物,相对分子质量从几万到几百万.如图为丙氨酸分子结构模型,下列关于丙氨酸的说法正确的是( )| A. | 它是由四种元素组成的有机高分子化合物 | |
| B. | 每个丙氨酸分子中含有13个原子核 | |
| C. | 丙氨酸分子中含有3个碳原子 | |
| D. | 丙氨酸分子中氮、氧元素的质量比为1:2 |
| A. | x=0.5,a=8 | B. | x=0.5,a=10 | C. | x=1.5,a=8 | D. | x=1.5,a=10 |