题目内容
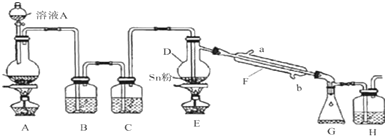
11.部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:
下列说法正确的是( )
| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | B. | 样品CuO的质量一定为4.0g | ||
| C. | 样品中Fe元素的质量为56V/22400g | D. | 样品中Fe元素的质量为2.24 g |
分析 硫酸足量,由氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol,以此来解答.
解答 解:A.生成的滤渣3.2g是铜,金属铜可以和Fe3+反应,所以一定不含有Fe3+,则溶液A中含Fe2+、H+,故A错误;
B.Fe的物质的量为$\frac{3.2g}{160g/mol}$×2=0.04mol,其质量为0.04mol×56g/mol=2.24g,CuO质量不超过5.76-2.24=3.52g,故B错误;
C.由于铁不仅仅与酸反应生成氢气,则不能仅根据氢气的体积计算铁的质量,故C错误;
D.Fe的物质的量为$\frac{3.2g}{160g/mol}$×2=0.04mol,其质量为0.04mol×56g/mol=2.24g,故D正确.
故选D.
点评 本题考查金属及化合物的性质、混合物分离提纯综合应用等,为高频考点,把握物质的性质及氧化还原反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
1. 2011年8月,多家媒体报道部分山西老陈醋是由醋精勾兑而成,醋精就是冰醋酸.专家介绍,只要是符合国家标准的勾兑醋,是可以放心食用的.下列关于醋酸的说法中正确的是( )
2011年8月,多家媒体报道部分山西老陈醋是由醋精勾兑而成,醋精就是冰醋酸.专家介绍,只要是符合国家标准的勾兑醋,是可以放心食用的.下列关于醋酸的说法中正确的是( )
 2011年8月,多家媒体报道部分山西老陈醋是由醋精勾兑而成,醋精就是冰醋酸.专家介绍,只要是符合国家标准的勾兑醋,是可以放心食用的.下列关于醋酸的说法中正确的是( )
2011年8月,多家媒体报道部分山西老陈醋是由醋精勾兑而成,醋精就是冰醋酸.专家介绍,只要是符合国家标准的勾兑醋,是可以放心食用的.下列关于醋酸的说法中正确的是( )| A. | 0.01mol•L-l的醋酸溶液的Ph=2 | |
| B. | 向某温度下的醋酸溶液中通入HCl气体,醋酸的电离常数Ka会增大 | |
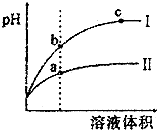
| C. | 等pH的盐酸与醋酸稀释后pH的变化如图所示,则曲线Ⅰ表示的是盐酸的稀释图象溶液体积 | |
| D. | 图中,a、b、c三点表示的溶液的导电性强弱关系为a<b<c |
19.下列物质,其水溶液能导电、溶于水时化学键被破坏,但物质本身属于非电解质的是( )
| A. | C12 | B. | NH3 | C. | BaCO3 | D. | C2H5OH (乙醇) |
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 在含4mol Si-O键的二氧化硅中,氧原子数为4NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
20.用NaBH4与FeCl3反应可制取纳米铁:2FeCl3+6NaBH4+18H2O=2Fe+6NaCl+6H3BO3+21H2↑.下列说法正确的是( )
| A. | 该反应中氧化剂只有FeCl3 | |
| B. | NaBH4的电子式为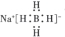 | |
| C. | NaBH4与稀硫酸不发生反应 | |
| D. | 该反应中每生成1 mol Fe,转移的电子数为3mol |
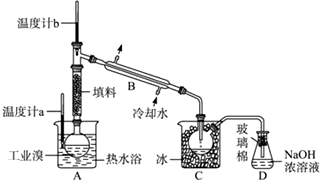
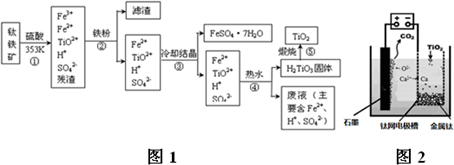
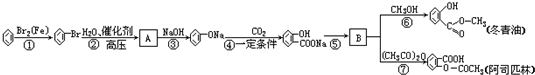
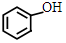 ;
; .
.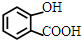 +NaHCO3→
+NaHCO3→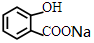 +CO2↑+H2O.
+CO2↑+H2O.