题目内容
4.不属于中学化学的基本理论知识范畴的是( )| A. | 勒夏特列原理 | B. | 元素周期律 | C. | 石油的成分 | D. | 电离平衡常数 |
分析 中学化学的理论体系包括:平衡移动理论、电离理论、水解理论、元素周期律、反应热与焓变等,据此分析.
解答 解:中学化学的理论体系包括:平衡移动理论、电离理论、水解理论、元素周期律、反应热与焓变等,而石油的成分不属于基本理论知识,属于元素化合物知识,故选C.
点评 本题考查了中学化学中的理论体系和知识体系,难度不大,应注意的是石油的成分不属于理论知识.

练习册系列答案
相关题目
15.工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
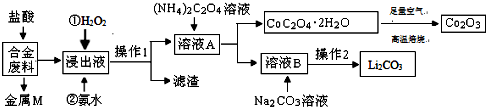
(1)金属M为Cu.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)CoC2O4•2H2O高温焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.

(1)金属M为Cu.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)CoC2O4•2H2O高温焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
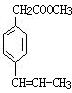
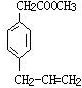
19.某有机物的结构为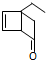 ,下列有关叙述不正确的是( )
,下列有关叙述不正确的是( )
 ,下列有关叙述不正确的是( )
,下列有关叙述不正确的是( )| A. | 不能发生加聚反应 | |
| B. | 分子式为C8H10O | |
| C. | 和足量氢气反应后的生成物中含有羟基 | |
| D. | 能发生银镜反应 |
9.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)SO2与过量NaOH溶液反应后的产物化学式Na2SO3.
(2)吸收尾气过程中,发生了很复杂的反应,其中Cl2只作氧化剂的氧化还原反应的离子方程式为Cl2+SO32-+2OH-═2Cl-+SO42-+H2O.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只有ClO-.
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3moL•L-1H2SO4、1moL•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
(1)SO2与过量NaOH溶液反应后的产物化学式Na2SO3.
(2)吸收尾气过程中,发生了很复杂的反应,其中Cl2只作氧化剂的氧化还原反应的离子方程式为Cl2+SO32-+2OH-═2Cl-+SO42-+H2O.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只有ClO-.
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3moL•L-1H2SO4、1moL•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3moL•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2: | |
| 步骤3: |
 Fe(OH)3(胶体)+3H+,生成的少量Fe(OH)3胶体可以吸附水中的悬浮杂质,达到净水的目的.
Fe(OH)3(胶体)+3H+,生成的少量Fe(OH)3胶体可以吸附水中的悬浮杂质,达到净水的目的.
 ;
; ;
; 和
和 .
.
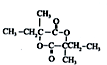 .
.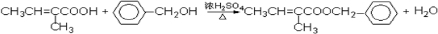 .
. 、
、 、
、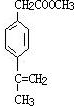 .
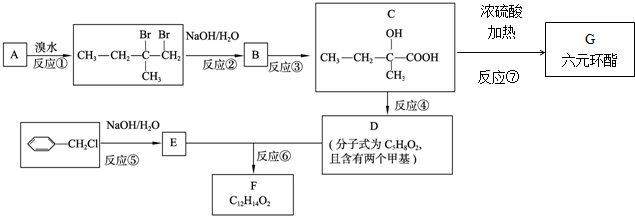
.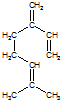 ,也可简写为
,也可简写为 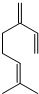 ,其分子式是C10H16,可以发生的化学反应有①④(选填序号).
,其分子式是C10H16,可以发生的化学反应有①④(选填序号).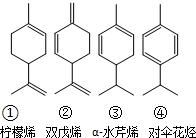
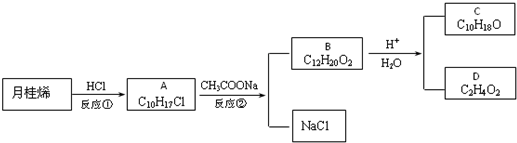
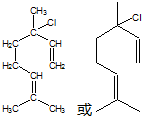 .
. .
.