题目内容
5.(Ⅰ)在银锌原电池中,以硫酸铜为电解质溶液.
(1)锌为负极,电极反应式为Zn-2e-=Zn2+.
(2)银电极上发生的是还原反应(“氧化”或“还原”),银电极上观察到的现象是析出红色的金属.
(3)此电池转移1mol电子,电解质溶液质量的变化为0.5g.
(Ⅱ)图2是氢氧燃料电池构造示意图.关于该电池说法,B极为正极.
(1)若电解质溶液为硫酸溶液,负极的电极反应H2-2e-=2H+.
(2)若电解质溶液为氢氧化钠溶液,则电池的总反应2H2+O2=2H2O.
分析 Ⅰ.银、锌、硫酸铜溶液构成原电池中,易失电子的锌作负极,银作正极,负极上发生失电子的氧化反应,正极上得电子发生还原反应,根据电子守恒结合电极反应来计算回答;
Ⅱ.氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,溶液的酸碱性不同,电极反应式不同,根据电解质环境书写电极反应式.
解答 解:Ⅰ.(1)银、锌、硫酸铜溶液构成原电池中,易失电子的锌作负极,负极上发生失电子的氧化反应:Zn-2e-=Zn2+,
故答案为:负;Zn-2e-=Zn2+;
(2)银、锌、硫酸铜溶液构成原电池中,银作正极,正极上得电子发生还原反应,即Cu2+得电子析出金属铜,现象是析出红色的金属,
故答案为:还原;析出红色的金属;
(3)负极上发生失电子的氧化反应:Zn-2e-=Zn2+,正极上得电子发生还原反应,即Cu2++2e-=Cu,当电池转移1mol电子,负极上减少锌32.5g,正极上析出金属铜32g,所以溶液的质量增大了0.5g,
故答案为:0.5;
Ⅱ.氢氧燃料电池中通入氧气的一极为原电池的正极,
故答案为:正;
(1)氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,酸性溶液中负极反应为:2H2-4e-=4H+,
故答案为:H2-2e-=2H+;
(2)氢氧燃料电池中通入氧气的一极为原电池的正极,发生还原反应,碱性溶液中正极反应为O2-4e-+2H2O=4OH-,负极反应为:2H2-4e-+4OH-═4H2O,总反应为:2H2+O2=2H2O,
故答案为:2H2+O2=2H2O.
点评 第Ⅰ题考查原电池的工作原理、电极反应式的书写、电子守恒的计算等知识,难度中等;第Ⅱ题考查氢氧燃料电池的工作原理,题目难度不大,注意电解质溶液的酸碱性不同,电极反应不同,此为易错点.

| A. | 放电时,蓄电池由化学能转化为电能 | |
| B. | 充放电时,溶液的导电能力变化不大 | |
| C. | 放电时的负极反应式为 Pb-2e-═Pb2+ | |
| D. | 充电时的阳极反应式为 Pb2++4OH-+2e-═PbO2+2H2O |
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-22.5kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=+890kJ•mol-1 | |
| C. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=-890kJ•mol-1 | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=-1780kJ•mol-1 |
| A. | 用pH试纸测得氯水的pH=2;用带磨口玻璃塞的试剂瓶保存K2CO3溶液 | |
| B. | 用酸式滴定管或移液管量取20.00 mL酸性K2Cr2O7溶液 | |
| C. | 用托盘天平称取5.85 g NaNO3晶体;用10mL量筒量取6.8mL稀H2SO4 | |
| D. | 酸碱中和滴定时,滴定管和锥形瓶都需用标准液或待测液润洗 |
| A. | NO与O2反应生成NO2 | |
| B. | N2 与H2 在一定条件下反应生成NH3 | |
| C. | NH3 经催化氧化生成NO | |
| D. | 由NH3制碳酸氢铵和硫酸铵 |
| A. | 15 | B. | 16 | C. | 19 | D. | 20 |

| A. | ①③ | B. | 只有② | C. | ②和③ | D. | 全部 |
| A. | SO3的水溶液能导电,所以SO3是电解质 | |
| B. | 自由移动离子数目多的电解质溶液导电能力一定强 | |
| C. | NaHSO4在水溶液里及熔融状态下均可电离出Na+、H+、SO${\;}_{4}^{2-}$ | |
| D. | NH3属于非电解质,但其水溶液能够导电 |
 C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: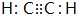 ;D的最简式为CH2.
;D的最简式为CH2. ,其反应类型为取代反应.
,其反应类型为取代反应.