题目内容
14.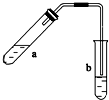 可用图示装置制取少量乙酸乙酯(部分图中均已略去).请填空:
可用图示装置制取少量乙酸乙酯(部分图中均已略去).请填空:(1)试管a中反应的化学方程式:CH3COOH+CCH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(2)试管b中盛放的试剂是饱和碳酸钠溶液.
(3)为防止a中的液体在实验时发生暴沸,
在加热前应采取的措施是加入几粒沸石
(4)试管b中导管未伸入液面下的原因是防止倒吸
(5)反应过程中,可观察到b中的现象是溶液分为两层,有香味.反应结束后,振荡试管b,静置.观察到的现象是b溶液分层,上层是透明的油状液体.
分析 乙酸和乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯,乙酸乙酯不溶于饱和碳酸钠溶液,且乙酸、乙醇易挥发,则乙酸乙酯中混有乙酸、乙醇,乙酸可与碳酸钠反应,乙醇易溶于水,可用饱和碳酸钠溶液吸收乙醇、乙酸,且溶液分层,注意防止倒吸,以此解答该题.
解答 解:(1)乙酸和乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯,反应的化学方程式为CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(2)乙酸乙酯不溶于饱和碳酸钠溶液,乙酸可与碳酸钠反应,乙醇易溶于水,可用饱和碳酸钠溶液吸收乙醇、乙酸,故答案为:饱和碳酸钠溶液;
(3)加热纯液体,应防止暴沸,可加入几粒沸石,故答案为:加入几粒沸石;
(4)乙醇、乙酸易溶于水,则球形干燥管除起冷凝作用外,另一个重要作用是防止倒吸,
故答案为:防止倒吸;
(5)乙酸乙酯具有香味,且不溶于饱和碳酸钠溶液,溶液分层,反应结束后,振荡试管b,静置.观察到的现象是b溶液分层,上层是透明的油状液体,
故答案为:溶液分为两层,有香味;b溶液分层,上层是透明的油状液体.
点评 本题考查物质的制备,侧重于学生的分析、实验以及计算能力的考查,注意把握有机物反应的特点以及常见仪器的使用,把握实验的原理和操作方法,难度不大.

练习册系列答案
相关题目
12.下列物质属于电解质的是( )
| A. | AgCl | B. | 硝酸钾溶液 | C. | NH3 | D. | 二氧化碳 |
19.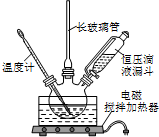 硝基苯是医药和染料的中间体,还可做有机溶剂.反应如图:
硝基苯是医药和染料的中间体,还可做有机溶剂.反应如图:
①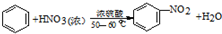
②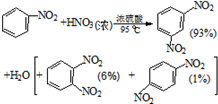
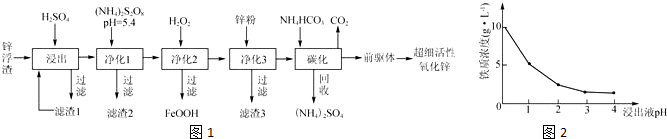
组装如图反应装置.有关数据列表如表:
制备硝基苯流程如图:
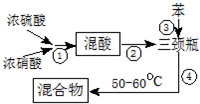
请回答:
(1)步骤①配制混酸:取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,操作是:在烧杯中先加入18mL浓硝酸,再,并不断搅拌、冷却;把配好的混和酸加入恒压漏斗中;最后在三颈烧瓶中加入18mL苯.
(2)在室温下向三颈瓶中的苯逐滴加入混酸,边滴边搅拌,混和均匀、加热.实验装置中长玻璃管最好用球形冷凝管代替(填仪器名称);上图中的加热方式称为;反应温度控制在50~60℃的原因是水浴加热、防止副反应反应.
硝基苯的提纯步骤为:

(3)步骤⑤表明混合物中有苯和硝基苯的操作和现象是混合物倒入蒸馏水中,液体分为三层.
(4)验证步骤⑥中液体已洗净的操作和现象是:取最后一次洗涤液,向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;为了得到更纯净的硝基苯,还须先向液体中加入无水CaCl2除去水,然后蒸馏(填操作名称).
(5)设计实验证明中:“粗产品中2”中含二硝基苯.
(6)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示)反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O.
 硝基苯是医药和染料的中间体,还可做有机溶剂.反应如图:
硝基苯是医药和染料的中间体,还可做有机溶剂.反应如图:①
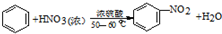
②

组装如图反应装置.有关数据列表如表:
| 物质 | 熔点/ ℃ | 沸点 /℃ | 密度(20℃) /g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶 |

请回答:
(1)步骤①配制混酸:取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,操作是:在烧杯中先加入18mL浓硝酸,再,并不断搅拌、冷却;把配好的混和酸加入恒压漏斗中;最后在三颈烧瓶中加入18mL苯.
(2)在室温下向三颈瓶中的苯逐滴加入混酸,边滴边搅拌,混和均匀、加热.实验装置中长玻璃管最好用球形冷凝管代替(填仪器名称);上图中的加热方式称为;反应温度控制在50~60℃的原因是水浴加热、防止副反应反应.
硝基苯的提纯步骤为:

(3)步骤⑤表明混合物中有苯和硝基苯的操作和现象是混合物倒入蒸馏水中,液体分为三层.
(4)验证步骤⑥中液体已洗净的操作和现象是:取最后一次洗涤液,向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;为了得到更纯净的硝基苯,还须先向液体中加入无水CaCl2除去水,然后蒸馏(填操作名称).
(5)设计实验证明中:“粗产品中2”中含二硝基苯.
(6)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示)反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O.
4.下列物质在水溶液中的电离方程式书写错误的是( )
| A. | Fe2(SO4)3═2Fe3++3SO42- | B. | KClO3═K++Cl-+O32- | ||
| C. | KAl(SO4)2═K++Al3++2SO42- | D. | NaHSO4═Na++H++SO42- |
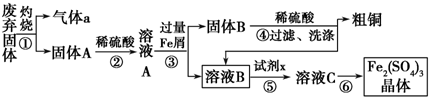
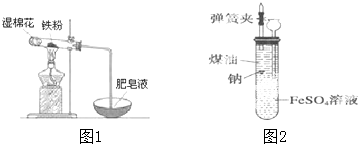 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.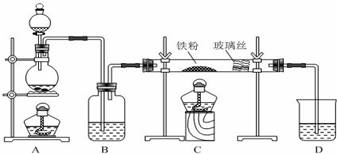
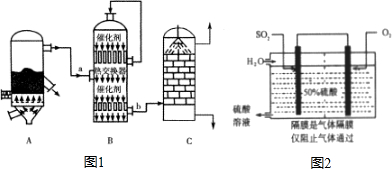 硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:
硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题: