题目内容
氯气是一种重要的工业原料.工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.该反应中氧化剂是 ,若反应中转移了3mol电子,则生成了 mol N2.工作人员通过能否看到白烟判断管道是否漏气,请结合上述反应,写出生成的白烟的化学式 .
考点:氯气的化学性质,氧化还原反应
专题:卤族元素
分析:3Cl2+2NH3═N2+6HCl中,Cl元素的化合价降低,N元素的化合价升高;看到白烟判断管道是否漏气,是因HCl与NH3反应生成NH4Cl固体,以此来解答.
解答:
解:3Cl2+2NH3═N2+6HCl中,Cl元素的化合价降低,则为氧化剂Cl2,转移6mol电子生成1molN2,则若反应中转移了3mol电子,则生成了0.5molN2;利用看到白烟判断管道是否漏气,是因HCl与NH3反应生成NH4Cl固体,观察到有白烟生成,
故答案为:Cl2;0.5;NH4Cl..
故答案为:Cl2;0.5;NH4Cl..
点评:本题考查氯气的化学性质及氧化还原反应,为高频考点,注意从元素化合价角度及实验现象分析,注重化学与生活、工业生产的联系,题目难度不大.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol Na2O2中含有的阴离子数为0.2NA |
| B、标准状况下,由H2O2制得2.24LO2转移的电子数目为0.4NA |
| C、常温常压下,8g O3含有4 NA个电子 |
| D、常温下,1L pH=2的H2SO4溶液中含有的H+数目为0.02NA |
下列各物质中,属于电解质且溶于水后溶液呈酸性的是( )
| A、HNO3 |
| B、NaOH |
| C、NH3 |
| D、Na |
解释下列事实的化学用语正确的是( )
| A、将NH3通入滴有酚酞的水中,溶液变红:NH3+H2O?NH3?H2O?NH4++OH- | ||||
B、铜与浓硫酸共热产生气体:Cu+H2SO4(浓)
| ||||
| C、CH3COONa的水溶液呈碱性:CH3COO-+H2O═CH3COOH+OH- | ||||
| D、用NaOH溶液吸收Cl2:Cl2+2OH-═2Cl-+H2O |

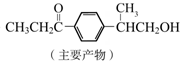 +HCl
+HCl
 与1分子
与1分子  也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为