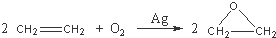题目内容
8.中和0.1mol•L-1相同体积的NaOH溶液,需用0.1mol•L-1 HCl、H2SO4、H3PO4溶液的体积之比为( )| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 6:3:2 |
分析 根据反应H++OH-=H2O,结合分子组成计算,其中HCl是一元强酸、H2SO4是二元强酸、H3PO4是三元弱酸,由此分析解答.
解答 解:根据反应H++OH-=H2O可知,中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,
则需:n(HCl):n(H2SO4):n(H3PO4)=1:$\frac{1}{2}$:$\frac{1}{3}$=6:3:2,
需要相同物质的量浓度的HCl、H2SO4、H3PO4溶液的体积比为6:3:2,
故选D.
点评 本题考查化学方程式计算、物质的量浓度计算,比较基础,明确发生的反应即可解答,有利于基础知识的巩固.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
18.表中实验操作能达到实验目的是( )
| 实验操作 | 实验目的 | |
| A | 向苯酚钠溶液中通入二氧化碳 | 确定苯酚酸性较碳酸弱 |
| B | 向加有铁粉的苯中加浓溴水 | 制取溴苯 |
| C | 向新制的氢氧化铜中加入乙醛溶液,加热 | 证明乙醛可被还原 |
| D | 将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的溴离子 |
| A. | A | B. | B | C. | C | D. | D |
20.有关乙烯的性质与反应,下列说法中不正确的是( )
| A. | 能与1molH2发生加成反应生成 | |
| B. | 易被酸性KMnO4溶液氧化而使KMnO4溶液褪色 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 一定条件下能与H2O发生加成反生成乙醚 |
16.下列说法正确的是( )
| A. | 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 | |
| D. | 植物油和矿物油都不能使溴水褪色 |
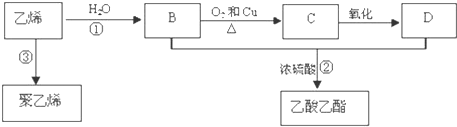
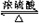 CH3COOC2H5+H2O;③
CH3COOC2H5+H2O;③ .
.