题目内容
8.和OH-具有相同质子数和不同电子数的微粒是( )| A. | F | B. | Cl- | C. | NH3 | D. | NH2- |
分析 氢氧根离子中质子数为各元素的质子数之和,一个氢氧根离子中的质子数是9个,电子数是10个.
解答 解:A.F中质子数是9,电子数是9,和氢氧根离子具有相同质子数和不同电子数,故A正确;
B.Cl-中质子数是17,电子数是17+1=18,和氢氧根离子具有不相同质子数和不同电子数,故B错误;
C.氨气分子中质子数是10,电子数是10,所以和氢氧根离子中质子数不相同,电子数相同,故C错误.
D.NH2-中质子数是9,电子数是7+2+1=10,所以和氢氧根离子具有相同质子数和电子数,故D错误;
故选A.
点评 本题考查了原子、离子中质子数和电子数的计算,题目难度不大,明确原子中质子数=电子数,阳离子中质子数=电子数+电荷数,阴离子中质子数=电子数-电荷数是解答关键.

练习册系列答案
相关题目
13.下列判断正确的是( )
| A. | 分散系一定是混合物 | |
| B. | 胶体的分散质不能透过滤纸 | |
| C. | 任何物质在水中都有一定的溶解度 | |
| D. | 胶体和其它分散质的本质区别是能发生丁达尔现象 |
16.将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,明显不正确的是( )
| A. |  分散系的分类 | |
| B. |  稀释浓盐酸的过程 | |
| C. |  向碳酸钠溶液中逐滴滴入盐酸 | |
| D. |  向氯化铝溶液中滴加氢氧化钠至过量 |
3. 向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )
向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )
 向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )
向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )| A. | 该实验表明化学能可以转化为热能 | |
| B. | NaOH溶液的浓度大于1.00 mol•L-1 | |
| C. | V=50 mL时,混合液呈碱性 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
13.下列关于铝的性质和用途描述正确的是( )
| A. | 铝能与所有的酸和碱反应放出氢气 | |
| B. | 用酒精灯外焰加热铝箔,可以看到少量液滴悬而不落,说明铝的熔点比氧化铝高 | |
| C. | 铝合金质轻,强度大,耐腐蚀,可以用作门窗 | |
| D. | 氢氧化铝能溶于氨水 |
17.下列变化规律中正确的是( )
| A. | 金属Na、Mg、A1熔、沸点由高到低 | |
| B. | HC1、HBr、HI的还原性由弱到强 | |
| C. | H+、Li+、H-的半径由小到大 | |
| D. | 同浓度的硫酸钠、乙酸钠、碳酸钠溶液的碱性由强到弱 |
18.将5.6克不纯的铁与足量稀硫酸反应,生成氢气0.2克.该不纯的铁含有的杂质可能是( )
| A. | 碳和锌 | B. | 铁锈 | C. | 碳和铝 | D. | 碳 |
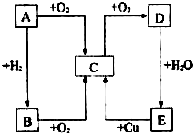 如图所示,A、B、C、D、E五种物质的相互转化关系,B能使紫色石蕊试纸变蓝.请回答:
如图所示,A、B、C、D、E五种物质的相互转化关系,B能使紫色石蕊试纸变蓝.请回答: ⑦
⑦