题目内容
12.钠、镁、铝、铁、铜等金属共有的性质是( )| A. | 都是银白色金属,易导电、导热 | B. | 都具有还原性,都能置换酸中的氢 | ||
| C. | 都需要用电解法冶炼 | D. | 都能与其他金属或非金属形成合金 |
分析 A.铜为红色;
B.铜的活泼性排在氢的后面;
C.铁、铜用热还原法冶炼;
D.合金是指把金属加热熔合其他金属或非金属形成的具有金属特性的混合物.
解答 解:A.铜为红色,不是银白色,故A错误;
B.铜的活泼性排在氢的后面,不能置换酸中的氢,故B错误;
C.钠、镁、铝用电解法冶炼,铁、铜用热还原法冶炼,故C错误;
D.钠、镁、铝、铁、铜都能与其他金属或非金属形成合金,故D正确.
故选D.
点评 本题考查金属的通性,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.元素的性质呈周期性变化的根本原因是( )
| A. | 随着元素相对原子质量的递增,量变引起质变 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 元素的金属性和非金属性呈周期性变化. |
20.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,VL CHCl3含有的碳原子数为$\frac{V}{22.4}$NA | |
| B. | 常温常压下,1mol乙基所含的电子总数为17NA | |
| C. | 12g C60中含有60NA个电子 | |
| D. | 1mol HNO3见光分解,转移电子数为4NA |
7.下列有关碱金属铷(Rb)的叙述中,不正确的是( )
| A. | Rb2CO3易溶、易电离 | |
| B. | Rb位于周期表第五周期第ⅠA族 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷和盐酸反应的离子方程式是OH-+H+═H2O |
17.(双选)下列化学反应中电子转移的表示方法正确的是( )
| A. | 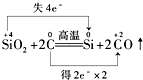 | |
| B. |  | |
| C. |  | |
| D. |  |
1.对于反应Br2+SO2+2H2O=2HBr+H2SO4和2HBr+H2SO4(浓)=Br2+SO2↑+2H2O,下列说法中正确的是( )
| A. | 氧化性浓H2SO4>Br2,还原性:SO2>HBr | |
| B. | 它们互为可逆反应 | |
| C. | 反应条件的改变引起了反应方向的改变,它们都符合事实 | |
| D. | 它们相互矛盾,不可能符合事实 |