题目内容
17.(双选)下列化学反应中电子转移的表示方法正确的是( )| A. | 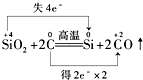 | |
| B. |  | |
| C. |  | |
| D. |  |
分析 氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目.
解答 解:A.Si元素化合价由+4价降低为0价,得到电子,C元素失去电子,化合价从0价升高为+2价,最小公倍数为4,转移电子为4e-,故A错误;
B.H元素化合价由+1降低为0价,总共降低2价,得到2个电子,Na元素从0价升高为+1价,共失去2个电子,最小公倍数为2,转移电子为2e-,故B正确;
C.I元素化合价由-1价升高为0价,失去电子,Mn元素化合价从+7价降低为+2价,得到电子,最小公倍数为10,转移电子10e-,故C正确;
D.Cu元素化合价由0价升高为+2价,失去电子,S元素化合价由+6价降低为+4价,得到电子,最小公倍数为2,转移电子2e-,故D错误;
故选BC.
点评 本题考查氧化还原反应的特征和实质知识,中等难度,关键判断准化合价变化总数.

练习册系列答案
相关题目
10.下列物质属于共价化合物的是( )
| A. | N2 | B. | CO2 | C. | NaCl | D. | NaOH |
8.下列对一些事实的理论解释正确的是( )
| 选项 | 客观事实 | 理论解释 |
| A | Na+比Na原子稳定 | Na+最外电子层有8个电子而Na只有1个 |
| B | 熔化状态下NaCl能导电而NaCl晶体不能导电 | 熔化状态下的NaCl中存在离子而NaCl晶体中没有离子 |
| C | 钾原子比钠原子更易失去电子 | 钾的核电荷数比钠的多 |
| D | 纯碱溶液能使湿润的紫色石蕊试纸变蓝色 | 纯碱能电离出OH-而使石蕊试纸变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
5.下列各组离子在指定的溶液中不能大量共存的是( )
| A. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| B. | 1 mol•L-1的烧碱溶液中:S2-、SO32-、SO42-、K+ | |
| C. | 使淀粉碘化钾试纸变蓝的溶液:Cs+、Ba2+、S2-、Cl- | |
| D. | 含有大量HCO3-的澄清透明溶液中:K+、NH4+、SO42-、MnO4- |
12.钠、镁、铝、铁、铜等金属共有的性质是( )
| A. | 都是银白色金属,易导电、导热 | B. | 都具有还原性,都能置换酸中的氢 | ||
| C. | 都需要用电解法冶炼 | D. | 都能与其他金属或非金属形成合金 |
6.下列各制定粒子数目不等于阿伏伽德罗常数值的是( )
| A. | 1gH2所含的原子个数 | |
| B. | 4g氮气所含的原子个数 | |
| C. | 16gO2所含的分子个数 | |
| D. | 23g金属Na全部转变为金属离子时失去的电子个数 |
7.实验室有一种含有少量二氧化硅杂质的石灰石样品,某同学想准确测定该样品的纯度,他取用2.0g样品于烧杯中,把20.0mL稀盐酸分4次加入,充分作用后记录烧杯中固体质量表.请选择合适的数据并计算:
(1)该样品中的纯度是多少;
(2)所取用的稀盐酸的物质的量浓度?
(3)如果该同学选用稀硝酸测定样品纯度,你认为将对结果有何影响?
| 次序 | 稀盐酸(mL) | 余固体(g) |
| 1 | 先加入5.0mL | 1.32 |
| 2 | 再加入5.0mL | 0.64 |
| 3 | 再加入5.0mL | 0.20 |
| 4 | 再加入5.0mL | 0.20 |
(2)所取用的稀盐酸的物质的量浓度?
(3)如果该同学选用稀硝酸测定样品纯度,你认为将对结果有何影响?