题目内容
下列说法正确的是
| 选项 | 实验 | 解释或结论 |
| A | 用洁净的Pt丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+, 无K+ |
| B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
| C | 向溴水中滴入植物油,振荡后,油层显无色 | 溴不溶于油脂 |
| D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | H2O2的氧化性比Fe3+强 |
B
解析试题分析:A、因黄色光能遮挡紫色光,观察钾元素的焰色反应要通过蓝色钴玻璃,否则无法观察到钾元素的颜色,用洁净的Pt蘸取某溶液进行焰色反应,火焰呈黄色,不能说明不含钾元素,错误;B、CO2、H2O与Na2O2反应是放热反应,放出的热量达到脱脂棉的着火点,所以脱脂棉着火, B正确;C、植物油中含有碳碳双键,能和溴发生加成反应,导致油层显无色,错误;D、双氧水和硝酸都具有氧化性,混合溶液呈黄色,不能说明氧化剂是双氧水,错误。
考点:本题考查物质的性质、反应现象的分析。

 学习实践园地系列答案
学习实践园地系列答案CuSO4·5H2O是铜的重要化合物,有着广泛的应用。实验室用粗铜(含少量铁)制备CuSO4·5H2O的流程如下:
回答下列问题:
(1)实验室配制250 mL4.8 mol·L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要__________________________________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
除去Fe3+,溶液的pH应控在_______________范围,调pH可选用的试剂是____________。
(3)若制得的CuSO4·5H2O中存在杂质Cu(NO3)2,进一步提纯的实验操作名称是__________。
(4)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是____________。
用标准的BaCl2溶液测定晶体的纯度时,发现纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_____________________________________________(任写一种)。
(5)实验室欲制取适量NO气体。下图中最适合的实验装置是__________(填序号),并注明装置中所需药品的名称。
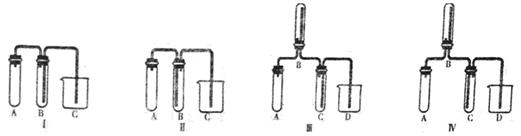
A.__________,B.__________,C.__________,D.__________。(根据选择的装置可以填满也可以不填满)
海带中含碘元素。从海带中提取碘有如下步骤:①在滤液中通人足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗加夜;⑤过滤。合理的操作顺序
| A.①②③④⑤ | B.②⑤①③④ | C.①③⑤②④ | D.②①③⑤④ |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干 燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
| A.Cl-不可能存在 | B.100mL溶液中含0.01mol CO32- |
| C.K+一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
下列措施可行且对应反应方程式正确的是
A.实验室用溴水和苯在催化剂作用下制溴苯: |
| B.工业上用H2冶炼金属钠:Na2O+H2△2Na+H2O |
| C.向溴乙烷中滴加AgNO3检验其中的溴原子:Ag++Br—=AgBr↓ |
| D.用氢氟酸雕刻玻璃:SiO2+4HF=SiF4↑+2H2O |
现有①乙酸乙酯和乙酸钠溶液、②溴化钠溶液和溴水、③苯和溴苯的混合液,分离它们的正确方法依次是
| A.分液、蒸馏、分液 | B.萃取、分液、蒸馏 |
| C.分液、萃取、蒸馏 | D.蒸馏、分液、萃取 |
能够鉴别醋酸溶液、葡萄糖溶液、蔗糖溶液的试剂是( )
| A.稀盐酸 | B.Cu(OH)2悬浊液 |
| C.NaOH溶液 | D.Na2CO3溶液 |
用下图所示装置(必要时可加热试管),不能完成的实验是
| A.试管中盛酚酞溶液,验证氨气的水溶液呈碱性 |
| B.试管中盛酸性高锰酸钾溶液,探究SO2的还原性 |
| C.试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物 |
| D.试管中盛淀粉KI溶液,验证氯气的氧化性 |
