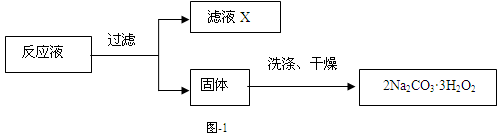
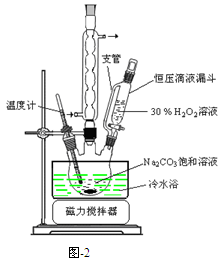
题目内容
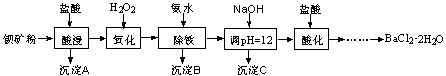
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。实验室用粗铜(含少量铁)制备CuSO4·5H2O的流程如下:
回答下列问题:
(1)实验室配制250 mL4.8 mol·L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要__________________________________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
除去Fe3+,溶液的pH应控在_______________范围,调pH可选用的试剂是____________。
(3)若制得的CuSO4·5H2O中存在杂质Cu(NO3)2,进一步提纯的实验操作名称是__________。
(4)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是____________。
用标准的BaCl2溶液测定晶体的纯度时,发现纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_____________________________________________(任写一种)。
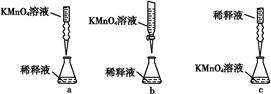
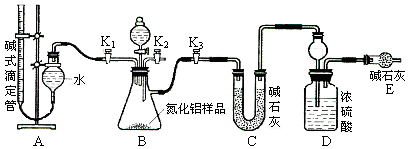
(5)实验室欲制取适量NO气体。下图中最适合的实验装置是__________(填序号),并注明装置中所需药品的名称。
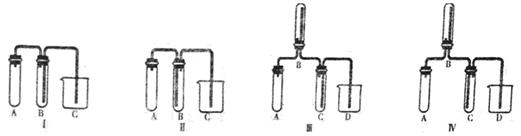
A.__________,B.__________,C.__________,D.__________。(根据选择的装置可以填满也可以不填满)
(1)250mL容量瓶、胶头滴管
(2)3.7≤pH<4.4 CuO、Cu(OH)2、Cu2(OH)2CO3
(3)重结晶
(4)除去杂质,减少晶体的溶解损失
(5)Ⅰ A、稀硝酸与铜,B、水,C、水
解析试题分析:该题是通过粗铜经过除去铁杂质制备硫酸铜晶体的实验流程。(1)配置一定浓度的溶液需要专用的仪器——容量瓶,但要注明规格,定容时需要用到胶头滴管;(2)操作中因为Fe2+不易除去,需要把它氧化成Fe3+,然后通过调节pH生成Fe(OH)3除去,pH范围应是让Fe3+沉淀完全,Cu2+不出现沉淀,故应在3.7≤pH<4.4,可以选用的试剂应是不溶于水的、不能产生新杂质且能与酸反应促进水解的物质,故选用CuO、Cu(OH)2、Cu2(OH)2CO3等;(3)除去晶体中的可溶性杂质的方法是重结晶;(4)洗涤的作用首先是除去杂质,无机盐一般不溶于有机物,故用乙醇还有减少晶体的溶解损失的作用;BaCl2溶液测定晶体测定的是晶体中SO42-,晶体的纯度大于100%说明SO42-的量偏高,可能是含有其他含SO42-百分含量高于硫酸铜晶体的物质,还有可能是晶体失去部分结晶水导致SO42-的量偏高;
(5)实验室欲制取NO气体需用稀硝酸与铜反应,NO只能用排水法收集,故选用Ⅰ,A盛放稀硝酸与铜,B盛放水,用来收集NO,C是排出的水。
考点:考查实验基本知识,涉及实验仪器的选择、实验操作等内容。

 阅读快车系列答案
阅读快车系列答案可以把6种无色溶液:乙醇、苯酚、Na2CO3溶液、AgNO3溶液、KOH溶液、氢硫酸,区分的试剂是
| A.新制碱性Cu(OH)2悬浊液 | B.FeCl3溶液 |
| C.BaCl2溶液 | D.酸性KMnO4溶液 |
下图是用实验室制得的乙烯(C2H5OH  CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是( )
CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是( )
| A.装置①和装置③中都盛有水,其作用相同 |
| B.装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同 |
| C.产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出 |
| D.制备乙烯和生成1,2-二溴乙烷的反应类型分别是消去反应和加成反应 |
下列说法正确的是
| 选项 | 实验 | 解释或结论 |
| A | 用洁净的Pt丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+, 无K+ |
| B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
| C | 向溴水中滴入植物油,振荡后,油层显无色 | 溴不溶于油脂 |
| D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | H2O2的氧化性比Fe3+强 |
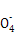 +8H+
+8H+ 5Fe3++Mn2++4H2O)。
5Fe3++Mn2++4H2O)。