题目内容
关于等质量的SO2和SO3的比较,正确的是( )
| A、所含分子的个数比为2:3 |
| B、所含原子的个数比为1:1 |
| C、所含硫原子的物质的量之比为5:4 |
| D、在相同状况下气体的体积比为4:5 |
考点:物质的量的相关计算
专题:计算题
分析:根据n=
可知,等质量的SO2和SO3的物质的量之比为80g/mol:64g/mol=5:4.
A.根据N=nNA可知,分子数目之比等于其物质的量之比;
B.结合分子含有原子数目计算所含原子总物质的量,进而计算原子数目之比;
C.每个SO2、SO3分子都含有1个S原子,含有S原子数目之比等于其分子物质的量之比;
D.相同体积气体体积之比等于气体物质的量之比.
| m |
| M |
A.根据N=nNA可知,分子数目之比等于其物质的量之比;
B.结合分子含有原子数目计算所含原子总物质的量,进而计算原子数目之比;
C.每个SO2、SO3分子都含有1个S原子,含有S原子数目之比等于其分子物质的量之比;
D.相同体积气体体积之比等于气体物质的量之比.
解答:
解:根据n=
可知,等质量的SO2和SO3的物质的量之比为80g/mol:64g/mol=5:4.
A.根据N=nNA可知,SO2和SO3的分子数目之比为5:4,故A错误;
B.等质量的SO2和SO3含有原子数目之比为5×3:4×4=15:16,故B错误;
C.每个SO2、SO3分子都含有1个S原子,含有S原子数目之比等于其分子物质的量之比,故等质量的SO2和SO3含有S原子数目之比为5:4,故C正确;
D.相同体积气体体积之比等于气体物质的量之比,则等质量的SO2和SO3的体积之比为5:4,故D错误,
故选C.
| m |
| M |
A.根据N=nNA可知,SO2和SO3的分子数目之比为5:4,故A错误;
B.等质量的SO2和SO3含有原子数目之比为5×3:4×4=15:16,故B错误;
C.每个SO2、SO3分子都含有1个S原子,含有S原子数目之比等于其分子物质的量之比,故等质量的SO2和SO3含有S原子数目之比为5:4,故C正确;
D.相同体积气体体积之比等于气体物质的量之比,则等质量的SO2和SO3的体积之比为5:4,故D错误,
故选C.
点评:本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组溶液中的离子能大量共存,且向溶液中加入NaOH溶液时产生白色沉淀,加入盐酸时放出气体的一组是( )
| A、OH-Ba2+NO3-K+ |
| B、Na+ SO42- Cu2+ Cl- |
| C、HCO3- Cl- Na+ Ba2+ |
| D、Fe3+ Al3+ I- NO3- |
氯气能和氢氧化钠反应,Cl2在反应Cl2+2NaOH═NaCl+NaClO+H2O中( )
| A、被氧化 |
| B、被还原 |
| C、既被氧化又被还原 |
| D、既未被氧化又未被还原 |
能正确表示下列反应的离子方程式是( )
| A、稀盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
| B、钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
| C、硝酸银中加入铜:2Ag++Cu=2Ag+Cu2+ |
| D、氢氧化钡中加入硫酸:Ba2++SO42-=BaSO4↓ |
能正确表示下列反应的离子方程式的是( )
| A、NaHS溶液的水解方程式:HS-+H2O?H3O++S2- |
| B、足量的硫酸铝溶液与纯碱溶液反应:2A13++3CO32-+3H2O=2A1(OH)3↓+3CO2↑ |
| C、Fe(OH)3与足量的HI溶液反应:Fe(OH)3+3H+=Fe3++3H2O |
| D、向亚硫酸氢铵溶液中加入足量的NaOH溶液:NH4++OH-=NH3?H2O |







 生成A的反应类型是
生成A的反应类型是

 和足量的H2反应,最多可消耗H2
和足量的H2反应,最多可消耗H2 的反应得到
的反应得到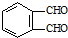 ,请写出该同分异构体的结构简式:
,请写出该同分异构体的结构简式: