题目内容
20.回答下列问题:(1)已知两种同素异形体A、B的燃烧热的热化学方程式为:
A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol
B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol
则两种同素异形体中较稳定的是(填“A”或“B”)A.
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol.该反应的热化学方程式是H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol.
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=-72kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol-1
氢气与氧气反应生成水蒸气的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1.
现有1mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应.
若x=0.2时,反应①放出的能量为14.4kJ.
若x=0.75时,反应①与②放出(或吸收)的总能量为0.
分析 (1)由①A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol;②B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol,根据盖斯定律:①-②分析反应的热效应,能量越高越不稳定;
(2)反应方程式为:H2+Cl2=2HCl,根据吸收的能量之和与放出的能量之和的相对大小判断反应的吸放热,二者的差值即为焓变的数值;
(3)据热化学方程式和盖斯定律计算写出热化学方程式;据图象写出水与甲烷反应的热化学方程式和氧气与甲烷反应的热化学方程式,再据热化学方程式计算.
解答 解:(1)由①A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol;②B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol,根据盖斯定律:①-②得:A(s)=B(s)△H>0,所以B的能量高,能量越高越不稳定,A稳定,故答案为:A;
(2)反应方程式为:H2+Cl2=2HCl,生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,放出能量:2×431kJ=862kJ,放出的能量大于吸收的能量,则该反应放热,焓变为负号,且放出的热量为:864kJ-679kJ=185kJ,所以△H=-183KJ/mol,所以反应的热化学方程式是H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol;
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol;
(3)①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=-72kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g)△H2=+216 kJ•mol-1
依据盖斯定律$\frac{1}{2}$①-②得到氢气与氧气反应生成水蒸气的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1,CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol-1
,2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=-72kJ•mol-1,
若x=0.2,有0.8molH2O(g)和0.2molO2(g),0.2mol氧气反应放热0.2mol×36KJ/mol×2=14.4KJ;
反应①与②放出(或吸收)的总能量为0时,设水蒸气物质的量为amol,则氧气物质的量为(1-a)mol,有216KJ/mol×amol=72KJ/mol×(1-a)mol,解得:a=0.25mol,所以x=$\frac{1-0.26}{1}$=0.75;
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1;14.4;0.75.
点评 本题考查了据能量变化图书写热化学方程式和据热化学方程式的计算,注意盖斯定律的计算应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 硫酸钡 | B. | 蔗糖 | C. | 醋酸 | D. | 二氧化硫 |
| A. | 摩尔是国际单位制中的七个基本物理量之一 | |
| B. | 阿伏加德罗常数是0.012kg 12C中所含的原子数 | |
| C. | 摩尔质量与物质的量的多少有关,它等于物质的质量除以物质的量 | |
| D. | 阿伏加德罗常数的符号为NA,近似为6.02×1023 |
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 常温下,100mL1mol/LNa2CO3溶液中阴离子总数大于0.1NA | |
| C. | 1L0.1mol/L醋酸溶液中含有H+数目为0.1NA | |
| D. | 将0.1mol氯化铁溶于水中配成1L溶液,所得溶液中含有的Fe3+数目为0.1NA |
| A. | 红磷在氯气中反应,1mol红磷失去的电子数一定为5NA | |
| B. | 标准状况下22.4L C3H8中含中子数为18NA | |
| C. | 1L 1mol/L的葡萄糖溶液中,含有的分子数为NA个 | |
| D. | 常温下78 g过氧化钠和122 g水混合,所得溶液质量分数为40% |

| A. | 溶液与胶体属于包含关系 | |
| B. | 化合物与氧化物属于包含关系 | |
| C. | 电解质与化合物属于交叉关系 | |
| D. | 氧化还原反应与化合反应属于并列关系 |
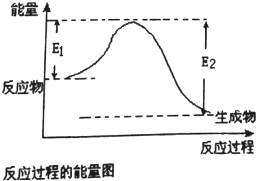 已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题:
已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题: ,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.
,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.