题目内容
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末同时生成氯化钠.该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”.同学们对此有下列一些理解,其中错误的是( )
| A、金刚石属于金属单质 |
| B、制造过程中Na是还原剂 |
| C、CCl4是一种化合物 |
| D、这个反应是置换反应 |
考点:氧化还原反应,单质和化合物
专题:
分析:CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末同时生成氯化钠,反应中C、Na元素化合价发生变化,钠为还原剂,CCl4为氧化剂,以此解答.
解答:
解:反应的方程式为4Na+CCl4
C+4NaCl,
A.金刚石是碳元素组成的单质,属于非金属单质,故A错误;
B.反应中Na元素化合价升高,被氧化,为还原剂,故B正确;
C.CCl4由不同种元素组成的纯净,属于化合物,故C正确;
D.CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末的过程是钠单质置换出碳单质的过程,属于置换反应,故D正确.
故选A.
| ||
A.金刚石是碳元素组成的单质,属于非金属单质,故A错误;
B.反应中Na元素化合价升高,被氧化,为还原剂,故B正确;
C.CCl4由不同种元素组成的纯净,属于化合物,故C正确;
D.CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末的过程是钠单质置换出碳单质的过程,属于置换反应,故D正确.
故选A.
点评:本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念的考查,题目难度不大.

练习册系列答案
相关题目
卫生填埋、焚烧、堆肥等是垃圾的常用处理方法.下列垃圾中,不适合用这些方法处理的是( )
| A、医疗垃圾 | B、厨余垃圾 |
| C、废纸垃圾 | D、废旧电池 |
下列各组离子,在pH>7的溶液中能量共存,且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Cl-、SO42- |
| B、Na+、NO3-、CO32-、Cl- |
| C、Na+、H+、NO3-、SO42- |
| D、Ca2+、NO3-、CO32-、Cl- |
含Ba(OH)2l mol的稀溶液与足量稀盐酸反应,放出114.6kJ的热量,表示该反应中和热的热化学方程式正确的是( )
| A、Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l);△H=-114.6kJ/mol | ||||
| B、Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l);△H=+114.6kJ/mol | ||||
C、
| ||||
D、
|
相同物质的量的N2和CO两者相比较,下列叙述中不正确的是( )
| A、所含分子数相等 |
| B、所含原子总数相等 |
| C、摩尔质量相等 |
| D、所占的体积一定相等 |
下列离子方程式不正确的是( )
| A、澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | ||||
B、用惰性电极电解NaHS溶液:HS-+H2O
| ||||
| C、向摩尔盐溶液中加入过量的Ba(OH)2溶液:2NH4++Fe2++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)2↓+2NH3.H2O | ||||
| D、明矾溶液中加入Ba(OH)2溶液至生成的沉淀质量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,下列叙述正确的是( )
| A、饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| B、向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| C、向0.0008 mol?L-1的K2CrO4溶液中加入等体积的0.002mol/LAgNO3溶液,则CrO42-完全沉淀 |
| D、将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液,则先产生AgCl沉淀 |
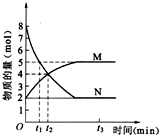 化学反应速率与化学平衡的理论研究对工农业生产有重要的意义.一定温度下,在容积为20L的密闭容器中进行a N(g)?b M(g) 的化学反应,M、N 的物质的量随时间的变化曲线如图所示:
化学反应速率与化学平衡的理论研究对工农业生产有重要的意义.一定温度下,在容积为20L的密闭容器中进行a N(g)?b M(g) 的化学反应,M、N 的物质的量随时间的变化曲线如图所示: