题目内容
4.下列排列顺序错误的是( )| A. | 化合物沸点:HI>HBr>HCl>HF | B. | 离子还原性:I->Br->Cl->F- | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 粒子半径:Al3+<Mg2+<F- |
分析 A.组成结构类似的氢化物的熔沸点取决于其相对分子质量的大小,还取决于氢键;
B.非金属性越强,其对应阴离子的还原性越弱;
C.元素的非金属性越强,其最高价氧化物对应水化物的酸性越强;
D.核外电子数相同的,原子序数越大,半径越小.
解答 解:A.由于HF中存在氢键,所以HF的熔沸点最高,故A错误;
B.由于非金属性F>Cl>Br>I,故离子的还原性:I->Br->Cl->F-,故B正确;
C.由于非金属性Cl>S>P>Si,所以酸性:H2SiO3<H3PO4<H2SO4<HClO4,故C正确;
D.电子层数越多半径越大,核外电子数相同的,原子序数越大,半径越小,F-、Mg2+、Al3+有2个电子层,F的原子序数最小,Al的原子序数最大,所以离子半径:Al3+<Mg2+<F-,故D正确,故选A.
点评 本题考查元素周期律的递变规律,为高频考点,注意把握元素的性质与对应单质、化合物的性质的关系,题目难度不大,学习中注意积累,侧重微粒性质比较的考查.

练习册系列答案
相关题目
14. 喷泉实验是一种常见的自然现象,其产生原因是存在压强差.在图中的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )
喷泉实验是一种常见的自然现象,其产生原因是存在压强差.在图中的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )
 喷泉实验是一种常见的自然现象,其产生原因是存在压强差.在图中的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )
喷泉实验是一种常见的自然现象,其产生原因是存在压强差.在图中的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )| A. | Cu与稀盐酸 | B. | NH4HCO3与稀盐酸 | ||
| C. | CaCO3与稀硫酸 | D. | NaHCO3与NaOH溶液 |
12.以极性键结合的多原子分子,分子是否有极性取决于分子的空间构型.下列分子属极性分子的是( )
| A. | SO3 | B. | CO2 | C. | NH3 | D. | BCl3 |
16.某学生提供的实验数据如下,其中肯定错误的是( )
①用10毫升的量筒量取7.60mL的液体
②用托盘天平称取22.5g KCl
③酸碱中和滴定时,消耗0.100 0mol•L-1的盐酸23.25mL
④用广泛pH试纸测得某溶液的pH=4.4.
①用10毫升的量筒量取7.60mL的液体
②用托盘天平称取22.5g KCl
③酸碱中和滴定时,消耗0.100 0mol•L-1的盐酸23.25mL
④用广泛pH试纸测得某溶液的pH=4.4.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
13.某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失.
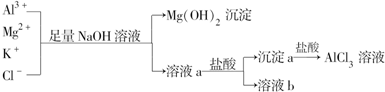
下列说法正确的是( )

下列说法正确的是( )
| A. | NaOH溶液可以用氨水来代替 | |
| B. | 沉淀a为NaAlO2 | |
| C. | 溶液b中只含有NaCl | |
| D. | 向溶液a中滴加盐酸需控制溶液的pH |
14.将SO2气体通入下列溶液中一定没有沉淀生成的是( )
| A. | 澄清石灰水 | B. | 盐酸酸化的Ba(NO3)2溶液 | ||
| C. | BaCl2溶液 | D. | BaCl2与NaOH的混合溶液 |
 NOx是汽车尾气中的主要污染物之一.通过NOx传感器可监测NOx的含量,其工作原理如图:
NOx是汽车尾气中的主要污染物之一.通过NOx传感器可监测NOx的含量,其工作原理如图: