题目内容
20.Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为22.4 L.分析 由方程式可知,当3molNH3参加反应时,有2molNH3被氧化,根据方程式计算.
解答 解:由方程式可知,当3molNH3参加反应时,有2molNH3被氧化,消耗Cl21.5mol则
3Cl2+8NH3=6NH4Cl+N2 ~被氧化2molNH3
3 2
1.5 n
$\frac{3}{1.5}=\frac{2}{n}$,解得n=1mol,
则被氧化的NH3在标准状况下的体积为1mol×22.4L/mol=22.4L,
故答案为:22.4.
点评 本题考查氧化还原的计算,题目难度不大,本题注意氨气并没有全部被氧化.

练习册系列答案
相关题目
6.硫酸铜晶体中结晶水含量测定,需用的仪器有( )
| A. | 容量瓶 | B. | 分液漏斗 | C. | 干燥器 | D. | 滴定管 |
7.下列属于氧化还原反应同时能量的变化符合如图的是( )
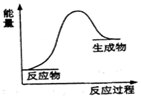

| A. | Ba(OH)2•8H2O与NH4Cl反应 | |
| B. | 铝与稀盐酸 | |
| C. | 灼热的炭与水蒸气生成一氧化碳和氢气的反应 | |
| D. | 煤与O2的燃烧反应 |
5.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 铝片与稀盐酸的反应 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 天然气在氧气中的燃烧反应 |
12.据报导,我国已研制出“可充室温钠一二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠一四甘醇二甲醚,电池总反应为:4Na+3CO2 $?_{充电}^{放电}$2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上.下列叙述不正确的是( )
| A. | 放电时钠金属片发生氧化反应 | |
| B. | 充电时碳纳米管接直流电源的正极 | |
| C. | 放电时每消耗3molCO2,转移12 mol电子 | |
| D. | 充电时的阳极反应为C+2Na2CO3-4e-=3CO2↑+4Na+ |
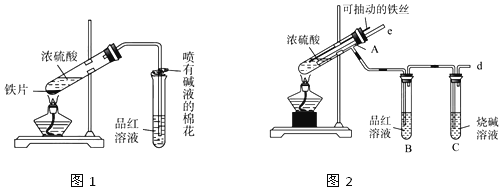
9.实验是化学研究的基础,下图关于各实验装置(夹持装置已略去)的叙述,正确的是( )
| A. |  装置可用于模拟侯氏制碱法制取碳酸氢钠 | |
| B. |  装置可用于制备少量NH3 | |
| C. |  装置可用于准确量取一定体积K2Cr2O7标准溶液 | |
| D. |  装置常用于分离互不相溶的液体混合物 |
10.聚苯乙烯塑科在生产,生活中有广泛应用,其单体苯乙烯可由乙苯和二氧化碳在一定条件下发生如下反应制取: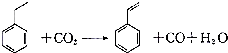 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 苯乙烯分子中含有4个碳碳双键 | B. | 苯乙烯分子式为C8H10 | ||
| C. | 乙苯有三种同分异构体 | D. | 乙苯能发生取代、加成和氧化反应 |