题目内容
 如图为钠硫高能电池的结构示意图,M为Na2O和Al2O3的混合物,电池反应为2Na+xS?Na2Sx该电池的工作温度为320℃左右,下列说法错误的是( )
如图为钠硫高能电池的结构示意图,M为Na2O和Al2O3的混合物,电池反应为2Na+xS?Na2Sx该电池的工作温度为320℃左右,下列说法错误的是( )| A、a为电池正极,b为电池负极 |
| B、电池放电时,正极反应为xS+2e-=Sx2- |
| C、电池充电时,Na所在电极连接电源正极 |
| D、M的作用为导电和隔离钠和硫 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由方程式可知反应中Na被氧化,应为原电池负极反应,电极方程式为Na-e?=Na+,S化合价降低,被还原,为原电池正极反应,电极方程式为xS+2e?→Sx2?,原电池工作时,M起到导电和隔绝Na、S的作用,以此解答该题.
解答:
解:A.b极Na被氧化,应为原电池负极反应,电极方程式为Na-e?=Na+,a极S化合价降低,被还原,为原电池正极反应,电极方程式为xS+2e?→Sx2?,a为电池正极,b为电池负极,故A正确;
B.正极上硫得电子发生还原反应,所以正极电极反应式为:xS+2e-═Sx2-,故B正确;
C.钠离子转化为钠单质,发生还原反应,连接电源负极,故C错误;
D.原电池工作时,M起到导电和隔绝Na、S的作用,故D正确;故选C.
B.正极上硫得电子发生还原反应,所以正极电极反应式为:xS+2e-═Sx2-,故B正确;
C.钠离子转化为钠单质,发生还原反应,连接电源负极,故C错误;
D.原电池工作时,M起到导电和隔绝Na、S的作用,故D正确;故选C.
点评:本题考查了原电池原理,明确正负极上得失电子及反应类型是解本题关键,难点是电极反应式的书写,易错题是B,根据M晶体的类型确定M的导电作用,难度很大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 氢氧化钡 | 蔗糖溶液 | 硫酸钡 | 醋酸 | 氢气 |
| B | 胆矾 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| C | 盐酸 | 石灰水 | 苛性钾 | 水 | 氨气 |
| D | 石灰石 | 水玻璃 | 氯化钙 | 氢氧化铁 | 碳酸钙 |
| A、A | B、B | C、C | D、D |
 温度为T时,向2.00L恒容密闭容器中充入1.00molCH4,发生反应:2CH4(g)
温度为T时,向2.00L恒容密闭容器中充入1.00molCH4,发生反应:2CH4(g)
| ||
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(CH4)/mol | 1.00 | 0.84 | 0.81 | 0.80 | 0.80 |
| A、温度T时,前5s H2平均速率为0.024mol?L-1?s-1 |
| B、温度T时,b点 υ(逆)>υ(正) |
| C、该反应的平衡常数随温度升高逐渐减小 |
| D、温度T时,若向2.00L恒容密闭充入2.00molC2H2和6.00molH2,达到平衡时,C2H2转化率大于80% |
下列实验方案正确且能达到相应实验预期目的是( )
A、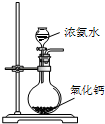 制备少量氨气 |
B、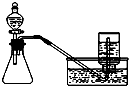 用铜和浓硝酸制取少量NO2 |
C、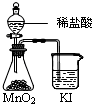 比较MnO2、Cl2、I2的氧化性 |
D、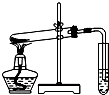 探究NaHCO3的热稳定性 |
下列各组离子在溶液中不能大量共存的是( )
| A、H2PO4-、NH4+、K+、Mg2+ |
| B、Mg2+、Na+、Cl-、F- |
| C、H+、Cl-、SO42-、K+ |
| D、K+、Zn2+、Br-、NO3- |
化学与生产生活、社会发展密切相关,下列有关说法不正确的是( )
| A、我国城市生活垃圾处理问题日益严峻,建议在大中城市兴建现代化的垃圾焚烧处理厂 |
| B、随着工业发展,大气中的二氧化碳浓度不断增大,温室效应日益严重,回收利用二氧化碳合成可降解塑料,将成为解决这一问题的可能途径 |
| C、在工业生产中,研制出在较低温度和压强下能使反应迅速进行的催化剂,可起到很好的节能效果,能体现十八大提出的“绿色发展”理念 |
| D、对苯二甲酸和乙二醇通过加聚反应得到的聚对苯二甲酸乙二酯是目前产量较大的合成纤维 |

