题目内容
16.对于1mol/L的NaOH溶液,下列有关说法正确的是(NA表示阿伏加德罗常数)( )| A. | Na+的数目为NA | B. | OH-的物质的量为1mol | ||
| C. | Na+的物质的量浓度为1mol/L | D. | NaOH的质量为40g |
分析 1mol/L的NaOH溶液中,NaOH完全电离出Na+和OH-,Na+物质的量浓度为1mol/L,其物质的量根据n=cV计算.
解答 解:A.Na+的物质的量根据n=cV计算,溶液的体积不知道,无法计算,故A错误;
B.OH-的物质的量根据n=cV计算,溶液的体积不知道,无法计算,故B错误;
C.1mol/L的NaOH溶液中,Na+和OH-的物质的量浓度均为1mol/L,故C正确;
D.溶液的体积不知道,无法计算,NaOH的物质的量和质量,故D错误.
故选C.
点评 本题考查了物质的量的有关计算,掌握公式的运用和物质的结构是关键,难度不大,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列物质在变化过程中,只需克服分子间作用力的是( )
| A. | 食盐溶解 | B. | 冰融化 | C. | 氯化铵受热分解 | D. | 氧化铝电解 |
18.16O和18O是氧元素的两种原子,NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 16O和18O互为同位素 | |
| B. | 16O和18O的化学性质、物理性质均相同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 1.12L16O2和1.12L18O2均有0.1NA个氧原子 |
11.下列叙述正确的是( )
| A. | 分子晶体中都存在共价键 | |
| B. | F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力有关 | |
| C. | 氯元素含氧酸酸性 HClO>HClO2 | |
| D. | 只要是离子化合物,其熔点一定比共价化合物的熔点高 |
1.常温下将盛有10mL NO2和10mL NO的混合气体的试管倒立于水槽中并向其中通入O2,一段时间后,试管内还剩余2mL气体,则通入O2的体积可能为( )
| A. | 8mL | B. | 8.5mL | C. | l0mL | D. | 10.5mL |
8.下列叙述正确的是( )
| A. | HBr、HI、HCl的稳定性依次减弱 | B. | RbOH、KOH、NaOH的碱性依次增强 | ||
| C. | K+、Na+、Li+的氧化性依次减弱 | D. | HIO4、HBrO4、HClO4的酸性依次增强 |
5.下列关于有机化合物的说法正确的是( )
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 戊烷有两种同分异构体 | |
| C. | 乙烯、聚乙烯和苯分子均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
6.25℃时,下列各组离子在指定溶液中可能大量共存的是( )
| A. | pH=l的溶液中:Na+、K+、MnO4-、I- | |
| B. | 无色溶液中:Al3+、NH4+、Cl-、S2- | |
| C. | 由水电离出的c(H+)=1×10 -3 mol•L-1的溶液中:Mg 2+、Cu 2+、SO42-、NO3- | |
| D. | 0.lmol•L-1FeC13溶液中:Fe 2+、NH 4 +、SCN-、SO42- |

 .
.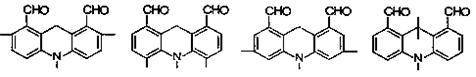 .
. 结构;
结构;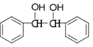 写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)
写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)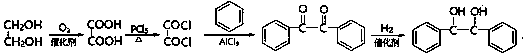 .
.