题目内容
4.设NA是阿伏加德罗常数的数值,下列说法正确的是( )| A. | 常温下,14g乙烯、丙烯、丁烯的混合气体,其原子数为3NA | |
| B. | 常温常压下,22.4L CO2含有CO2分子数为NA | |
| C. | 0.5mol•L-1 的CuCl2溶液中含Cl-数为 NA | |
| D. | 标准状况下,11.2L的CHCl3所含有的原子数为NA |
分析 A、乙烯、丙烯和丁烯的最简式均为CH2;
B、常温常压下气体摩尔体积大于22.4L/mol;
C、溶液体积不明确;
D、标况下三氯甲烷为液态.
解答 解:A、乙烯、丙烯和丁烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,则含3NA个原子,故A正确;
B、常温常压下气体摩尔体积大于22.4L/mol,故22.4L二氧化碳的物质的量小于1mol,分子个数小于NA个,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、标况下三氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量和含有的原子个数,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.已知:I2+2S2O32-=S4O62-+2I-.相关物质的溶度积常数见表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取 0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是溶液蓝色褪去,且半分钟内不变色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
③该试样中CuCl2•2H2O的质量分数为95%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取 0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是溶液蓝色褪去,且半分钟内不变色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
③该试样中CuCl2•2H2O的质量分数为95%.
19.已知: ,①②两步的产率均可达到90%以上,而RCOOH直接转化为RCOOR′产率在 60%左右,则下列说法不正确的是( )
,①②两步的产率均可达到90%以上,而RCOOH直接转化为RCOOR′产率在 60%左右,则下列说法不正确的是( )
 ,①②两步的产率均可达到90%以上,而RCOOH直接转化为RCOOR′产率在 60%左右,则下列说法不正确的是( )
,①②两步的产率均可达到90%以上,而RCOOH直接转化为RCOOR′产率在 60%左右,则下列说法不正确的是( )| A. | ①②两步均为取代反应 | |
| B. | ①②总产率比羧酸直接与醇反应产率高 | |
| C. | SOCl2若与足量羧酸反应产物除了 外,还有硫酸 外,还有硫酸 | |
| D. | SOCl2可以和水反应,故①反应不能用醋酸水溶液 |
13.不能用浓硫酸干燥的气体是( )
| A. | NH3 | B. | SO2 | C. | Cl2 | D. | HCl |
3.下列反应不能通过一步反应实现的是( )
| A. | Cu→CuSO4 | B. | Fe→FeCl2 | C. | Al2O3→Al(OH)3 | D. | Fe(OH)2→Fe(OH)3 |

 ;
;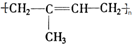 其单体的键线式
其单体的键线式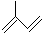 ;
;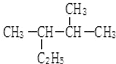 的名称(系统命名法)2,3-二甲基戊烷.
的名称(系统命名法)2,3-二甲基戊烷.