题目内容
8.两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n.下列说法不正确的是( )| A. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X | |
| B. | 若8>m>3,则X必定为主族元素 | |
| C. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子 | |
| D. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y |
分析 A、若a<b<m=n=4,二者处于ⅣA族,X为C元素、Y为Si,都形成原子晶体,共价键越短,熔沸点越高;
B、若8>m>3,则X处于ⅢA~ⅦA族;
C、若Y的气态氢化物化学式为YHn,且b=4,为处于ⅣA族,为正四面体构型;
D、若a=b=3,8>m>n>b,两种元素位于相同周期,且X原子序数较大,同周期元素从左到右,元素的非金属性逐渐增强.
解答 解:A.若a<b<m=n=4,二者处于ⅣA族,X为C元素、Y为Si,都形成原子晶体,金刚石中C-C键的键长<晶体Si中Si-Si,故C-C键更稳定,熔沸点:晶体硅<金刚石,故A错误;
B、若8>m>3,则X一定处于ⅢA~ⅦA族,故B正确;
C、若Y的气态氢化物化学式为YHn,且b=4,为处于ⅣA族,为正四面体构型,分子中正负电荷中心重合,属于非极性分子,故C正确;
D、若a=b=3,8>m>n>b,两种元素位于第三周期,且X原子序数较大,同周期元素从左到右,元素的非金属性逐渐增强,故则元素非金属性:X>Y,故D正确,
故选A.
点评 本题考查结构性质位置关系、分子结构与性质、晶体类型与性质等,难度中等,确定元素在周期表中位置是关键,注意元素的不确定性.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
18.下列关于钠原子和钠离子的叙述正确的是( )
| A. | 钠离子比钠原子少了一个质子 | |
| B. | 钠原子有还原性,钠离子有氧化性 | |
| C. | 钠原子和钠离子有相似的化学性质 | |
| D. | 钠原子不稳定,钠离子稳定,两者具有相同的电子层数 |
19.一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)?SiO2(s)+4HF(g)△H=+148.9kJ•mol-1
(1)下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示.
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:t1时反应已经达到化学平衡状态.
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应ade(填序号).
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大.
(1)下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示.
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应ade(填序号).
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大.
16.常温下能在浓HNO3中溶解的金属是( )
| A. | Al | B. | Ag | C. | Fe | D. | Pt |
3.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的X的数值:
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强);简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系原子半径越小,X的数值越大.
(3)请你预测Br与I元素的X数值的大小关系Br大于I.
(4)某化合物分子中含有S-N键,你认为该共享电子对偏向于N原子(填元素符号).
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强);简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系原子半径越小,X的数值越大.
(3)请你预测Br与I元素的X数值的大小关系Br大于I.
(4)某化合物分子中含有S-N键,你认为该共享电子对偏向于N原子(填元素符号).
20.中草药秦皮中含有的七叶树内酯结构是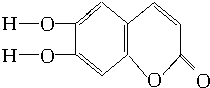 (C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
(C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
 (C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
(C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )| A. | 3 mol Br2、2 mol NaOH | B. | 3 mol Br2、4 mol NaOH | ||
| C. | 2 mol Br2、3 mol NaOH | D. | 4 mol Br2、4 mol NaOH |
 .
.