题目内容
17.2012年乌鲁木齐机动车保有辆迈入“50万辆时代”,汽车尾气已成为重要的空气污染物(1)汽车内燃机工作时引起反应:N2(g)+O2(g)=2NO(g),是导致汽车尾气中含有NO 的原因之一.T 0C时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO 物质的量为6mol,该反应的速率v(NO)为0.24mol/(L.min);该条件下的平衡常数1.2
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
则H2(g)与NO( g)反应生成N2 (g)和H2O(l)的热化 学方程式为2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol.
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率.
图1是反应:2NO(g)+2C0(g)=2CO2(g)+N2(g)中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应 的△H< O (填“>”、“<”或“无法确定”).若催化剂的表面积增大至S2,则反 应在T1、S2条件下达到平衡时NO的浓度不变(填“增大”、“减小”或“不变”)
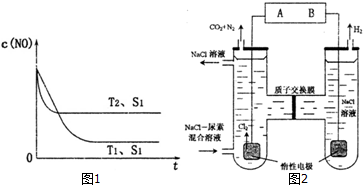
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),即通过阳极反应 生成具有强氧化作用的中间产物来氧化代谢产物,原理如图2:
①电源的负极为B (填“A”或“B”).
②阳极室中发生的反应为2Cl--2e-=Cl2↑、3Cl2+CO(NH2)2+H2O=6HCl+CO2+N2
③电解结束后,阴极室溶液的pH与电解前相比将不变;若两极共收集到气体13.44L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解).
分析 (1)利用三段式计算各组分物质的量变化量、平衡时各组分物质的量,再根据v=$\frac{△c}{△t}$计算v(NO);由于反应前后气体的体积不变,用平衡时物质的量代替浓度代入平衡常数表达式计算;
(2)①由盖斯定律②-①得H2(g)与N0( g)反应生成N2 (g)和H20(l)的热化学方程式;
②T2温度先得到平衡,说明反应速率快,故温度T2>T1,再根据平衡时NO的浓度,判断升高温度平衡影响方向,进而判断反应是吸热,还是放热;
催化剂的表面积增大,反应速率加快,但不影响平衡移动;
(3)①由图可知,右侧生成氯气,发生还原反应,故右侧为原电池的阴极;
②由图可知,阳极中氯离子生成氯气,尿素生成二氧化碳、氮气,最终导出NaCl溶液,故尿素、氯气、水反应生成HCl、二氧化碳与氮气;
③阴极是水放电生成氢气与碱,由电荷守恒可知,电解中左侧的氢离子通过质子交换膜加入右侧;
根据电子转移守恒,氯离子失去电子数等于生成氢气获得电子数,氢气体积等于氯气体积,而氯气又氧化尿素,结合方程式可知氯气与二氧化碳、氮气总体积关系,结合两极总体积计算二氧化碳、氮气总体积,由元素守恒可知二氧化碳与氮体积之比为1:1,进而计算尿素的质量.
解答 解:(1)向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,则:
N2(g)+O2(g)=2NO(g)
开始(mol):8 9 0
转化(mol):3 3 6
平衡(mol):5 6 6
故v(NO)=$\frac{\frac{6mol}{5L}}{5min}$=0.24mol/(L.min),
由于反应前后气体的体积不变,用平衡时物质的量代替浓度计算平衡常数,则K=$\frac{{6}^{2}}{5×6}$=1.2,
故答案为:0.24mol/(L.min);1.2;
(2)①已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol ①
2H2(g)+02(g)=2H2O(l)△H=-571.6kJ/mol ②
根据盖斯定律②-①得H2(g)与N0( g)反应生成N2 (g)和H20(l)的热化学方程式为2H2(g)+NO(g)=N2(g)+2H20(l)△H=(-571.6kJ/mol)-180.5kJ/mol=-752.1kJ/mol,
故答案为:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol;
②T2温度先得到平衡,说明反应速率快,故温度T2>T1,T2温度平衡时NO的浓度较大,说明升高温度,平衡向逆反应方向移动,故正反应为放热反应,即△H<O;
催化剂的表面积增大,反应速率加快,但不影响平衡移动,故平衡时时NO的浓度不变,
故答案为:<;不变;
(3)①由图可知,右侧生成氯气,发生还原反应,故右侧为原电池的阴极,连接电源B为负极,故答案为:B;
②由图可知,阳极中氯离子生成氯气,电极反应式为:2Cl--2e-=Cl2↑,尿素生成二氧化碳、氮气,最终导出NaCl溶液,故尿素、氯气、水反应生成HCl、二氧化碳与氮气,反应方程式为:3Cl2+CO(NH2)2+H2O=6HCl+CO2+N2,
故答案为:2Cl--2e-=Cl2↑; 3Cl2+CO(NH2)2+H2O=6HCl+CO2+N2;
③阴极是水放电生成氢气与碱,由电荷守恒可知,电解中左侧的氢离子通过质子交换膜加入右侧,最终溶液pH不变;
根据电子转移守恒,氯离子失去电子数等于生成氢气获得电子数,氢气体积等于氯气体积,而氯气又氧化尿素,结合3Cl2+CO(NH2)2+H2O=6HCl+CO2+N2 可知,氯气体积为二氧化碳、氮气总体积为1.5倍,而二者总体积为$\frac{13.44L}{1+1.5}$=5.376L,二氧化碳与氮体积之比为1:1,故氮气体积为5.376L×$\frac{1}{2}$=2.688L,其物质的量为$\frac{2.688L}{22.4L/mol}$=0.12mol,故尿素的物质的量为0.12mol,则尿素质量为0.12mol×60g/mol=7.2g,
故答案为:不变;7.2.
点评 本题属于拼合型题目,涉及化学反应速率、化学平衡常数计算、热化学方程式书写、化学平衡图象及影响因素、电解原理及有关计算,侧重考查学生对知识的迁移应用,(3)中阳极发生的有关反应为易错点、难点,注意根据图象分析发生的反应,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 氨水 | B. | NaHCO3 | C. | NaOH | D. | NaAlO2 |
| A. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X | |
| B. | 若8>m>3,则X必定为主族元素 | |
| C. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子 | |
| D. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y |
| A. | 扩大容器的容积,平衡向正反应方向移动 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 加入水蒸气使容器压强增大,平衡向逆反应方向移动 | |
| D. | 加入固体碳,平衡向正反应方向移动 |
| A. | 含有碳、氢元素的有机物 | B. | 含有碳元素的化合物 | ||
| C. | 完全燃烧只生成CO2和H2O的有机物 | D. | 仅由碳、氢两种元素组成的有机物 |
| A. | Cl2+H2O=HCl+HClO | B. | 2Na2O2+2H2O=4NaOH+O2? | ||
| C. | 2F2+2H2O=4HF+O2? | D. | 2Na+4H2O=2NaOH+H2? |
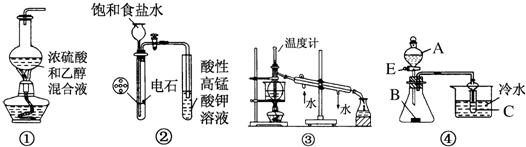
| A. | 图①用于实验室制乙烯 | |
| B. | 图②用于实验室制乙炔并验证乙炔发生氧化反应 | |
| C. | 图③用于实验室中石油的分馏 | |
| D. | 图④中若A为稀硫酸,B为纯碱(固体),C为苯酚钠溶液,则可验证硫酸、碳酸、苯酚酸性的强弱 |
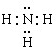 ,B的结构式为
,B的结构式为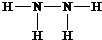 .
.