题目内容
14.下列变化属于加成反应的是( )| A. | 乙烯使酸性高锰钾溶液的紫色褪去 | |
| B. | 乙烯与水在一定条件下反应生成乙醇 | |
| C. | 苯与浓硫酸和浓硝酸的混合溶液反应生成油状物 | |
| D. | 乙醇在催化剂存在的条件下与氧气反应生成乙醛 |
分析 A.乙烯含碳碳双键,能被高锰酸钾氧化;
B.乙烯含碳碳双键;
C.生成硝基苯,苯环上H被硝基取代;
D.-OH转化为-CHO.
解答 解:A.乙烯使酸性高锰钾溶液的紫色褪去,为氧化反应,故A不选;
B.乙烯与水在一定条件下反应生成乙醇,为加成反应,故B选;
C.苯与浓硫酸和浓硝酸的混合溶液反应生成油状物为硝基苯,为取代反应,故C不选;
D.乙醇在催化剂存在的条件下与氧气反应生成乙醛,为氧化反应,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意官能团的变化,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
15.以NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 84gNaHCO3晶体中含有NA个CO32- | |
| B. | 1.8g重氧水中(H218O)含有NA个中子 | |
| C. | 标准状况下,11.2LO3中含有NA个氧原子 | |
| D. | 0.1molH3O+中含有NA个电子 |
5.今有如下三个热化学方程式:
H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=aKJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=bkJ•mol-1
2H2(g)+O2(g)=2H2O(l);△H=ckJ•mol-1
关于它们的下列表述不正确的是( )
H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=aKJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=bkJ•mol-1
2H2(g)+O2(g)=2H2O(l);△H=ckJ•mol-1
关于它们的下列表述不正确的是( )
| A. | 它们都是放热反应 | B. | a 和b的绝对值可以相等 | ||
| C. | a、b和c均为负值 | D. | 2b=c |
9.下列说法正确的是( )
| A. | CH2=CH-CH3 可形成顺反异构 | |
| B. | 含醛基的物质能发生银镜反应,但不能使酸性KMnO4溶液褪色 | |
| C. | 乙烯使溴水、酸性KMnO4溶液褪色但反应类型不同 | |
| D. | 苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠 |
19.下列说法正确的是( )
| A. | 某化合物在熔融态能导电,则该物质中一定含有离子键,可能含有共价键 | |
| B. | 冰是分子晶体,受热分解的过程中,只需克服分子间的作用力 | |
| C. | 某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,物理变化中一定没有化学键的破坏或形成 |
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴加石蕊显红色的溶液:K+、N${H}_{4}^{+}$、Cl-、S${O}_{4}^{2-}$ | |
| B. | 加铝粉能放出氢气的溶液:Na+、N${O}_{3}^{-}$、Cl-、Ba2+ | |
| C. | 使红色石蕊试纸变蓝色的溶液:Na+、Al3+、Cl-、HC${O}_{3}^{-}$ | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液:Fe2+、Cl-、Mn${O}_{4}^{-}$、S${O}_{4}^{2-}$ |
3.下述实验方案能达到实验目的是( )
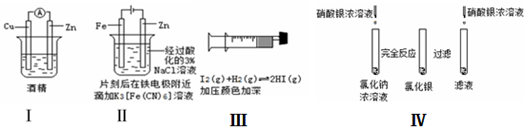

| A. | 方案Ⅰ验证金属活泼性:Zn>Cu | |
| B. | 方案Ⅱ验证Fe电极被保护 | |
| C. | 方案Ⅲ验证平衡移动原理 | |
| D. | 方案Ⅳ验证氯化银在水中存在溶解平衡 |
8.乙苯是一种用途广泛的有机原料,可制备多种化工产品.
(一)制备苯乙烯(原理如反应I所示):
Ⅰ. (g)?
(g)? (g)+H2 △H=+124KJ•mol-1
(g)+H2 △H=+124KJ•mol-1
(1)部分化学键的键能如表所示:
根据反应I的能量变化,计算X=612.
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.请用化学平衡理论解释通入水蒸气的原因:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)已知吉布斯自由能△G=△H-T△S,当△G<0时反应可自发进行.由此判断反应I在高温(填“高温”或“低温”)更易自发进行.
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ. (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(G)△H2>0
(g)+HCl(G)△H2>0
(4)T°C时,向10L恒容密闭容器中充入2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,乙苯(或Cl2)、α-氯乙基苯(或HCl)的物质的量浓度(c)随时间(t)变化的曲线如图所示:

①0-2min内,以HCl表示的该反应速率v(HCI)=0.05 mol•L-1•min-1.
②6min时,改变的外界条件为升高温度,该条件下的平衡常数K的数值=16.
③10min时,保持其他条件不变,再向容器中充入1mol乙苯、1mol Cl2、1molα-氯乙基苯和1mol HCl,则此时该反应v正>v逆(填“>”、“<”或“=”);若12min时反应再次达到平衡,则在0-12min内,Cl2的转化率α=86.7%.(计算结果保留三位有效数字)
(一)制备苯乙烯(原理如反应I所示):
Ⅰ.
 (g)?
(g)? (g)+H2 △H=+124KJ•mol-1
(g)+H2 △H=+124KJ•mol-1(1)部分化学键的键能如表所示:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/KJ/mol | 412 | 348 | X | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.请用化学平衡理论解释通入水蒸气的原因:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)已知吉布斯自由能△G=△H-T△S,当△G<0时反应可自发进行.由此判断反应I在高温(填“高温”或“低温”)更易自发进行.
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ.
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(G)△H2>0
(g)+HCl(G)△H2>0(4)T°C时,向10L恒容密闭容器中充入2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,乙苯(或Cl2)、α-氯乙基苯(或HCl)的物质的量浓度(c)随时间(t)变化的曲线如图所示:

①0-2min内,以HCl表示的该反应速率v(HCI)=0.05 mol•L-1•min-1.
②6min时,改变的外界条件为升高温度,该条件下的平衡常数K的数值=16.
③10min时,保持其他条件不变,再向容器中充入1mol乙苯、1mol Cl2、1molα-氯乙基苯和1mol HCl,则此时该反应v正>v逆(填“>”、“<”或“=”);若12min时反应再次达到平衡,则在0-12min内,Cl2的转化率α=86.7%.(计算结果保留三位有效数字)