题目内容
8.乙苯是一种用途广泛的有机原料,可制备多种化工产品.(一)制备苯乙烯(原理如反应I所示):
Ⅰ.
 (g)?
(g)? (g)+H2 △H=+124KJ•mol-1
(g)+H2 △H=+124KJ•mol-1(1)部分化学键的键能如表所示:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/KJ/mol | 412 | 348 | X | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.请用化学平衡理论解释通入水蒸气的原因:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)已知吉布斯自由能△G=△H-T△S,当△G<0时反应可自发进行.由此判断反应I在高温(填“高温”或“低温”)更易自发进行.
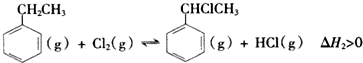
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ.
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(G)△H2>0
(g)+HCl(G)△H2>0(4)T°C时,向10L恒容密闭容器中充入2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,乙苯(或Cl2)、α-氯乙基苯(或HCl)的物质的量浓度(c)随时间(t)变化的曲线如图所示:

①0-2min内,以HCl表示的该反应速率v(HCI)=0.05 mol•L-1•min-1.
②6min时,改变的外界条件为升高温度,该条件下的平衡常数K的数值=16.
③10min时,保持其他条件不变,再向容器中充入1mol乙苯、1mol Cl2、1molα-氯乙基苯和1mol HCl,则此时该反应v正>v逆(填“>”、“<”或“=”);若12min时反应再次达到平衡,则在0-12min内,Cl2的转化率α=86.7%.(计算结果保留三位有效数字)
分析 (1)依据反应热=反应物总键能-生成物总能键能计算解答;
(2)保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
(3)反应自发进行的判断依据是△H-T△S<0;
(4)①图象分析可知,0-2minHCl生成浓度为0.1mol/L,反应速率v=$\frac{△c}{△t}$;
②6min后HCl浓度增大,氯气浓度减小,说明平衡正向进行,曲线变陡说明反应速率加快,改变的条件可以是升温;
T°C达到平衡状态,c(HCl)=0.16mol/L,c(Cl2)=0.04mol/L,结合化学平衡三行计算列式计算得到平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
③10min时,图象中得到平衡状态下物质的浓度,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,计算此时浓度商和平衡常数比较判断反应进行的方向,结合平衡常数和化学三行计算列式计算消耗氯气得到转化率.
解答 解:(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,设C=C键能为X,则△H=(5×412+348-3×412-X-436)kJ•mol-1=124kJ•mol-1,
解得X=612KJ/mol;
故答案为:612;
(2)正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动;
故答案为:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
(3) △H=+124kJ•mol-1,反应为气体体积增大的吸热反应,△H>0,△S>0,满足△H-T△S<0,需要高温条件下,
△H=+124kJ•mol-1,反应为气体体积增大的吸热反应,△H>0,△S>0,满足△H-T△S<0,需要高温条件下,
故答案为:高温;
(4)①T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,0-2min时,依据题干条件可知,c(HCl)=0.1mol/L,v=$\frac{\frac{△n}{V}}{△t}$=$\frac{0.1mol/L}{2min}$=0.05 mol•L-1•min-1,
故答案为:0.05 mol•L-1•min-1;
②制备α-氯乙基苯的正反应为吸热反应,反应前后气体的体积不变,6min时,乙苯、Cl2的浓度在减小,而α-氯乙基苯和HCl的浓度在增加,反应向正反应方向移动,只能是升高温度,5min时达到平衡,依据题干条件可知,c(HCl)=0.16mol/L,
起始(mol/L) 0.2 0.2 0 0
转化(mol/L) 0.16 0.16 0.16 0.16
平衡(mol/L) 0.04 0.04 0.16 0.16
平衡常数为K=$\frac{0.16×0.16}{0.04×0.04}$=16,
故答案为:升高温度;16;
③10min时,乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度分别为:0.02mol/L、0.02mol/L、0.18mol/L、0.18mol/L,平衡常数为K=$\frac{0.18×0.18}{0.02×0.02}$=81,此时乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度比为:1:1:9:9,保持其他条件不变,再向容器中充人1mol 乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,相当于增加反应物的浓度,平衡正向移动,V正>V逆,设0-12min消耗氯气浓度x,

起始(mol/L) 0.12 0.12 0.28 0.28
转化(mol/L) x x x x
平衡(mol/L) 0.12-x 0.12-x 0.28+x 0.28+x
K=$\frac{(0.28+x)(0.28+x)}{(0.12-x)(0.12-x)}$=81
x=0.08mol/L,
平衡状态氯气=0.12mol/L-0.08mol/L=0.04mol/L,0-12min氯气总浓度=0.3mol/L,
则氯气转化率=$\frac{0.3mol/L-0.04mol/L}{0.3mol/L}$×100%=86.7%,
故答案为:>;86.7%.
点评 本题考查了反应热的计算、化学平衡理论,明确反应热=反应物总键能-生成物总能键能,熟悉影响化学平衡移动的因素是解题关键,注意平衡常数计算和三段式计算,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 乙烯使酸性高锰钾溶液的紫色褪去 | |
| B. | 乙烯与水在一定条件下反应生成乙醇 | |
| C. | 苯与浓硫酸和浓硝酸的混合溶液反应生成油状物 | |
| D. | 乙醇在催化剂存在的条件下与氧气反应生成乙醛 |
| 实验操作、现象 | 得出的结论 | |
| A | 向一未知溶液的样品中,加入盐酸酸化的氯化钡溶液,生成大量白色沉淀 | 该溶液中一定含有SO42- |
| B | 向2.0mL浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1AgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
| C | 取少量蔗糖溶液,加入3~5滴稀硫酸,水浴加热后再加入少量新制的Cu(OH)2悬浊液,加热3~5分钟,无砖红色沉淀生成 | 蔗糖没有水解 |
| D | 向两支装有2mL 0.1mol•L-1草酸溶液的试管中,分别滴入4mL 0.01mol•L-1的高锰酸钾溶液、4mL 0.02mol•L-1的高锰酸钾溶液,发现加4mL 0.02mol•L-1的高锰酸钾溶液的试管先褪色 | 浓度越大,反应速率越快 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 甲中沉淀一定比乙多 | B. | 甲和乙中沉淀可能一样多 | ||
| C. | 甲中沉淀可能比乙多 | D. | 乙中沉淀一定比甲多 |
 有I-IV四个体积均为0.5L的恒容密闭容器,在I、II、III中按不同投料比(Z)充入 HCl和O2(如表),加入催化剂发生反应4HCl(g)+O2(g)?2Cl2 (g)+2H2O(g)△H,HCl的平衡转化率与Z和T的关系如图所示:下列说法不正确的是( )
有I-IV四个体积均为0.5L的恒容密闭容器,在I、II、III中按不同投料比(Z)充入 HCl和O2(如表),加入催化剂发生反应4HCl(g)+O2(g)?2Cl2 (g)+2H2O(g)△H,HCl的平衡转化率与Z和T的关系如图所示:下列说法不正确的是( )| 容器 | 起始时 | ||
| T/℃ | n(HCl)/mol | Z | |
| Ⅰ | 300℃ | 0.25 | a |
| Ⅱ | 300℃ | 0.25 | b |
| Ⅲ | 300℃ | 0.25 | 4 |
| A. | △H<0,a<4<b | |
| B. | 容器III某时刻处R点,则R点的v(正)<v(逆),压强:P(R)>P(Q) | |
| C. | 300℃该反应的平衡常数的值为640 | |
| D. | 若起始时,在容器Ⅳ中只充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中 HCl的物质的 量浓度大于0.2mol•L-1 |
 常温下,向 100mL0.01mol•L-1HA 溶液中逐滴加入0.02mol•L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述一定正确的是( )
常温下,向 100mL0.01mol•L-1HA 溶液中逐滴加入0.02mol•L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述一定正确的是( )| A. | 由图中信息可知HA为弱酸 | |
| B. | 在N点pH=7,酸碱恰好完全反应 | |
| C. | 常温时一定浓度的MA稀溶液显中性 | |
| D. | K 点对应的溶液中,c(M+)+c(MOH)=2c (A-) |
| A. | 配位体是Cl-和H2O,配位数是8 | |
| B. | 中心离子是Ti4+ | |
| C. | 内界和外界中的Cl-的数目比是1:2 | |
| D. | 在lmol该配合物中加入足量 AgNO3溶液,可以得到3mol AgCl沉淀 |


 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
 .
. .
. ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):