题目内容
用NA表示阿伏加德罗常数,则下列说法正确是( )
| A、常温常压下,11.2L CH4中含有的氢原子数为2NA |
| B、11.2 L CO2与8.5 g NH3所含分子数相等 |
| C、2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
| D、常温下,1L 0.1mol/L MgCl2溶液中含Mg2+ 数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.常温常压下,不能使用标况下的气体摩尔体积计算甲烷的物质的量;
B.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算二氧化碳的物质的量;
C.铝为3价金属,2.7g铝的物质的量为0.1mol,完全反应失去0.3mol电子;
D.根据n=cV计算出氯化镁的物质的量及镁离子数目.
B.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算二氧化碳的物质的量;
C.铝为3价金属,2.7g铝的物质的量为0.1mol,完全反应失去0.3mol电子;
D.根据n=cV计算出氯化镁的物质的量及镁离子数目.
解答:
解:A.常温下,不是标况下,不能使用标况下的气体摩尔体积计算11.2L甲烷的物质的量,故A错误;
B.不是标况下,题中条件无法计算11.2L二氧化碳的物质的量,故B错误;
C.2.7g铝的物质的量为0.1mol,0.1mol铝完全反应失去0.3mol电子,失去的电子数为0.3NA,故C正确;
D.1L 0.1mol/L MgCl2溶液中含有溶质氯化镁0.1mol,0.1mol氯化镁中含有0.1mol镁离子,含Mg2+数为0.1NA,故D错误;
故选C.
B.不是标况下,题中条件无法计算11.2L二氧化碳的物质的量,故B错误;
C.2.7g铝的物质的量为0.1mol,0.1mol铝完全反应失去0.3mol电子,失去的电子数为0.3NA,故C正确;
D.1L 0.1mol/L MgCl2溶液中含有溶质氯化镁0.1mol,0.1mol氯化镁中含有0.1mol镁离子,含Mg2+数为0.1NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下气体摩尔体积的使用条件,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气后都首先发生置换反应 |
| B、向FeBr2、FeI2混合液中,先通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则原溶液中的Br-一定被氧化 |
| C、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| D、过量的铜与浓硝酸反应有一氧化氮生成 |
一定条件下,在容积为5L的密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g),半分钟后测得生成0.02mol SO3.在这段时间内O2的化学反应速率(mol?L-1?min-1)为( )
| A、0.004 |
| B、0.008 |
| C、0.016 |
| D、0.032 |
下列能导电且属于电解质的是( )
| A、盐酸 | B、熔融KOH |
| C、固体食盐 | D、氯水 |
下列说法正确的是( )
A、按系统命名法,化合物 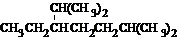 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 |
| B、等物质的量的乙烯、乙醇、丙烯酸分别充分燃烧,所耗用氧气的量相等 |
C、有机物 的分子式为C13H8O3,不可能所有原子共平面 的分子式为C13H8O3,不可能所有原子共平面 |
D、已知 ,反应物X与产物Y互为同分异构体,可用溴水反应加以分离 ,反应物X与产物Y互为同分异构体,可用溴水反应加以分离 |
在一定条件下,将E(g)和F(g)充入体积不变的2L密闭容器中,发生下述反应,并于5min末达到平衡:2E(g)+F(g)?2G(g).有关数据如表,下列判断正确的是( )
| E(g) | F(g) | G(g) | |
| 初始浓度(mol?L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol?L-1) | c1 | c2 | 0.4 |
| A、反应在前5min内,v(E)=0.04 mol/(L?min) |
| B、其他条件不变,若增大E的浓度,则达平衡时E的转化率会增大 |
| C、其他条件不变,降低温度,平衡时n(E)=3.0mol,则反应的△H>0 |
| D、平衡后移走2.0mol E和1.0mol F,在相同条件下再达平衡时,c(G)<0.2 mol?L-1 |
下列物质属于纯净物的是( )
| A、乙酸乙酯 | B、煤 |
| C、石油 | D、天然气 |
化学学习中,推理是一种重要的学习方法,下列推论正确的是( )
| A、由“BF3和SO3互为等电子体”,可推知二者均为非极性分子 |
| B、由“同主族元素性质相似,CO2为直线形分子”,可推知SiO2为直线形分子 |
| C、由“SiH4的熔沸点比CH4高”,可推知PH3的熔沸点比NH3高 |
| D、由“C、N、O三种元素的电负性C<N<O”,可推知第一电离能C<N<O |