题目内容
20.用离子方程式解释下列问题:(1)盛放烧碱液的试剂瓶不能用玻璃塞SiO2+2OH-=SiO32-+H2O;
(2)NaHCO3溶液中加少量Ca(OH)2溶液Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
(3)除去Na2CO3溶液中混有的NaHCO3HCO3-+OH-=CO32-+H2O;
(4)实验室制备氯气MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(5)在氯化铝溶液中加入与过量稀氨水制备氢氧化铝Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
分析 (1)二氧化硅与碱反应生成具有粘合性的硅酸钠;
(2)氢氧化钙少量,反应生成碳酸钙沉淀、碳酸钠和水;
(3)碳酸氢钠与氢氧化钠反应生成碳酸钠和水;
(4)二氧化锰与浓盐酸反应生成氯化锰、氯气、水;
(5)氯化铝和氨水反应生成氢氧化铝和氯化铵.
解答 解:(1)二氧化硅与碱反应生成具有粘合性的硅酸钠,反应的离子反应为:SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O;
(2)NaHCO3溶液中加少量Ca(OH)2溶液,反应生成碳酸钙、碳酸钠和水,反应的离子反应为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,
故答案为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-;
(3)可用氢氧化钠溶液除去Na2CO3溶液中混有的NaHCO3,反应的离子反应为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(4)二氧化锰与浓盐酸反应生成氯化锰、氯气、水,反应的离子反应为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(5)氯化铝和氨水反应生成氢氧化铝和氯化铵,反应的离子反应为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查离子方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式及电子、电荷守恒,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 向BaCl2溶液中通入SO2气体:Ba2++SO2+H2O=BaSO3↓+2H+ | |
| B. | FeBr2与Cl2物质的量1:1在溶液中反应:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | 向碳酸钠溶液中加入足量硫酸铝溶液:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3- | |
| D. | 苯酚钠溶液中通入少量二氧化碳: +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
( )
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
| A. |  称量 称量 | B. |  溶解 | C. |  转移 | D. |  定容 |
| A. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的重要原料 | |
| B. | 用瓷坩埚加热熔化氢氧化钠固体 | |
| C. | 向BaCl2溶液中通入SO2,溶液不变浑浊,再入CO2,溶液仍不变浑浊 | |
| D. | 氧化铝是冶炼金属铝的原料,也是比较好的耐火材料,可用来制造耐火坩埚、耐火管 |
| A. | Na2O | B. | SO3 | C. | CO2 | D. | NH3 |
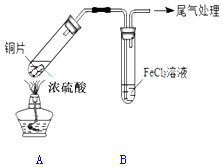 某校化学兴趣小组用如图装置进行SO2与FeCl3溶液的反应
某校化学兴趣小组用如图装置进行SO2与FeCl3溶液的反应