题目内容
1.A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A原子是所有原子中半径最小的,B原子的最外层电子数是次外层的3倍,C是第三周期最活泼的金属,D与B是同主族元素.下列说法正确的是( )| A. | 原子半径r(E)>r(D)>r(B) | |
| B. | A分别与C、E形成的化合物中化学键类型相同 | |
| C. | 熔沸点:A2B<A2D | |
| D. | 化合物DB2的排放是形成酸雨的原因 |
分析 A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A原子是所有原子中半径最小的,则A为H元素;B原子的最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,则B为O元素;C是第三周期最活泼的金属,则C为Na;D与B是同主族元素,则D为S元素,E的原子序数最大,故E为Cl.
解答 解:A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A原子是所有原子中半径最小的,则A为H元素;B原子的最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,则B为O元素;C是第三周期最活泼的金属,则C为Na;D与B是同主族元素,则D为S元素,E的原子序数最大,故E为Cl.
A.同周期自左而右原子半径减小,一般电子层越多原子半径越多,则原子半径r(S)>r(Cl)>r(O),故A错误;
B.A与C形成NaH,含有离子键,A与E形成HCl,含有共价键,故B错误;
C.水分子之间形成氢键,硫化氢分子之间为范德华力,故熔沸点:H2O>H2S,故C错误;
D.化合物SO2的排放是形成酸雨的原因,故D正确.
故选:D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意氢键对物质性质的影响,有利于基础知识的巩固.

练习册系列答案
相关题目
19.下列各组气体中,在通常情况下既能共存,又能用浓硫酸干燥的是( )
| A. | H2、O2、SO2 | B. | CO2、H2S、Cl2 | C. | HCl、HBr、HI | D. | NH3、HCl、CO2 |
20.A、B、C、D、E、F为原子序数逐渐增大的短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B 在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.回答下列问题:
(1)C的价电子排布式为2s22p3,写出一种工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱,向足量的其水溶液中通入少量F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3;
(3)由这些元素组成的物质,其组成和结构信息如表:
a的化学式为Na2O2或Na2C2;b的电子式为 ,其中B原子的杂化方式为sp2.
,其中B原子的杂化方式为sp2.
(1)C的价电子排布式为2s22p3,写出一种工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱,向足量的其水溶液中通入少量F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3;
(3)由这些元素组成的物质,其组成和结构信息如表:
| 物质 | 组成和结构信息 |
| a | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| b | 化学组成为BDF2 |
 ,其中B原子的杂化方式为sp2.
,其中B原子的杂化方式为sp2.
11.下列有关说法正确的是( )
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | |
| B. | 硅单质可用作光导纤维的原料 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值减小 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液pH 减小 |
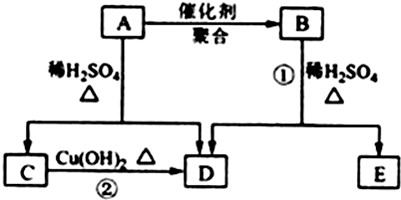
 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)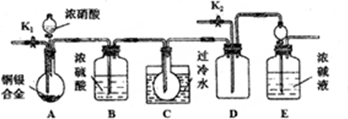
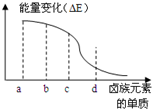 卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题: