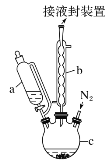
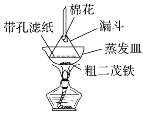
题目内容
【题目】下列有关说法中,不正确的是![]()
A.![]() 的HCN溶液与
的HCN溶液与![]() 的NaOH溶液等体积混合,所得溶液中
的NaOH溶液等体积混合,所得溶液中![]() ,则a一定小于b
,则a一定小于b
B.常温下,![]() 溶液的
溶液的![]() ,则
,则![]()
C.常温下,![]() 的某酸溶液中,若
的某酸溶液中,若![]() ,则溶液中由水电离出的
,则溶液中由水电离出的![]()
D.在![]() 的
的![]() 溶液中加入少量NaOH固体,
溶液中加入少量NaOH固体,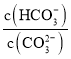 减小
减小
【答案】A
【解析】
A.等体积等浓度的HCN溶液和氢氧化钠溶液混合后,反应生成强碱弱酸盐NaCN,溶液显示碱性,一定满足![]() ,所以a
,所以a![]() 的HCN溶液与b
的HCN溶液与b![]() 的NaOH溶液等体积混合,所得溶液中
的NaOH溶液等体积混合,所得溶液中![]() ,则
,则![]() ,故A错误;
,故A错误;
B.![]() 溶液中,一定满足
溶液中,一定满足![]() ,溶液的
,溶液的![]() ,则
,则![]() 、
、![]() 、
、![]() ,所以
,所以![]() ,故B正确;
,故B正确;
C.常温下,![]() 的某酸溶液中,若
的某酸溶液中,若![]() =1×10-8,根据水的离子积可知:
=1×10-8,根据水的离子积可知:![]() ;酸溶液中的氢氧根离子是水电离的,所以该溶液中由水电离出的
;酸溶液中的氢氧根离子是水电离的,所以该溶液中由水电离出的![]() ,故C正确;
,故C正确;
D.![]() 在溶液中存在水解平衡:CO32-+H2O
在溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-,向0.1 molL-1的Na2CO3溶液中加入少量NaOH固体,平衡向左移动,故
HCO3-+OH-,向0.1 molL-1的Na2CO3溶液中加入少量NaOH固体,平衡向左移动,故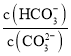 减小,故D正确;
减小,故D正确;
故答案为A。

 名校课堂系列答案
名校课堂系列答案【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
【题目】温度容积相同的3个密闭容器中,按不同方式投入反应物并保持恒温恒容,测得反应达到平衡时的有关数据如下![]() 已知:
已知:![]()
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol | 2mol | 4mol |
|
|
|
|
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系压强 |
|
|
|
反应物转化率 |
|
|
|
下列说法正确的是
A.![]() B.
B.![]() C.2
C.2![]() D.
D.![]()
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
平衡时n(C)/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是( )
A.K1=K2<K3
B.升高温度能加快反应速率的原因是降低了反应的活化能
C.实验Ⅱ比实验Ⅰ达平衡所需时间小的可能原因是使用了催化剂
D.实验Ⅲ达平衡后,恒温下再向容器中通入1molA和1molC,平衡正向移动