��Ŀ����
1�������仯��������Ҫ��;����ۺ�������[Fe2��OH��n��SO4��${\;}_{\frac{3-n}{2}}$]m��һ������Ч��ˮ���������������������K2FeO4��һ�����͡���Ч�������ɫˮ��������ij��ѧ̽��С��������·����Ʊ��������ֲ�Ʒ����ش��������⣺
��1����A����Ϊˮ��һ�������¿ɵ����Ĺ���������Fe3O4������Fe3O4�����Ļ��ϼۣ�Ӧʹ�õ��Լ���ACD�����ţ���
A��ϡ���� B��ϡ���� C��KSCN��Һ D�����Ը��������Һ
��2������Һ���м���NaClO3��д��������Fe2+�����ӷ���ʽ6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O��
��3��Fe2O3��KNO3��KOH�Ļ������ȹ��ڿ��Ƶ�K2FeO4����ɲ���ƽ���л�ѧ����ʽ��
��Fe2O3+��KNO3+��KOH-��K2FeO4+��KNO2+��H2O
�÷�Ӧ�е���������KNO3��ÿ����1mol K2FeO4ת��3mol���ӣ�
��4��Ϊ�ⶨ��ҺI����Ԫ�ص��ܺ�����ʵ�������ȷ��ȡ20.00mL��ҺI�ڴ�����ƿ�У���������H2O2������pH��3�����ȳ�ȥ����H2O2���������KI��ַ�Ӧ������ 0.1000mol•L-1 Na2S2O3����Һ�ζ����յ㣬���ı���Һ20.00mL��
��֪��2Fe3++2I-=2Fe2++I2 I2+2S2O32-=2I-+S4O62-
��д���ζ�ѡ�õ�ָʾ�����ۣ��ζ��յ�۲쵽��������Һ����ɫ����ɫ�Ұ���Ӳ���ɫ��
����ҺI����Ԫ�ص��ܺ���Ϊ5.6g•L-1�����ζ�ǰ��Һ��H2O2û�г��������ⶨ����Ԫ�صĺ�������ƫ�ߣ��ƫ�ߡ�����ƫ�͡��������䡱����
���� ��������Ϊԭ�ϣ��Ʊ��ۺ�������������أ���Ҫ�������Fe3+��Fe2+�ļ��飬�Լ����������ԭ��Ӧ���۷�����Ӧԭ�������û�ѧ����ʽ�����ӷ���ʽ��ʾ��������õζ�ԭ���ⶨ�ۺ������������ĺ������ɽ�Ϲ�ϵʽ������ԭ���غ���⣻
��1��������Fe3O4�����Ļ��ϼۣ���Ҫ�����ܽ��γ���Һ���ٷֱ�ȡ��������������Ӻ����������ӵĴ��ڣ�
��2����Һ���к����������ӣ����������£�ClO3-����Fe2+ΪFe3+����������ԭΪCl-�����ݵ�ʧ������ȡ�����غ㡢�����غ���ƽ��
��3����CΪKKO3��KOH�Ļ�����Fe2O3���ȹ����Ƶø�����أ���ȱ������ΪK2FeO4��H2O�����ݵ�ʧ������ȡ������غ���ƽ����Ӧ��KNO3������Ԫ�ػ��ϼ۽�������������ÿ����һ��ת�Ƶ�����Ϊ6-3=3��
��4���ٷ�Ӧԭ�����еⵥ�����ɺ����ģ��ⵥ������������ʾ��ɫ����ѡ����Ϊָʾ�������ⵥ����ȫ��Ӧ����Һ����ɫ��Ϊ��ɫ���ݴ��жϵζ��յ㣻
�ڸ��ݷ�Ӧ2Fe3++2I-�T2Fe2++I2��I2+2S2O32-�T2I-+S4O62-�ҳ���ϵʽFe3+��S2O32-��Ȼ����ݹ�ϵʽ����������ӵ����ʵ������ٸ���c=$\frac{n}{V}$�������Ԫ�غ���������˫��ˮ������S2O32-�����ʵ�����Ӱ���ж���
��� �⣺��1����������ǿ�����ԣ�ֻ��ѡ����ϡ�����ܽ�Fe3O4����������Һȡ������Ʒ��һ�ݵμ�KSCN��Һ����Һ��Ѫ��ɫ��֤����Һ����Fe3+����һ�ݵμ����Ը��̼���Һ����Һ��ɫ��ȥ����֪��Һ����Fe2+���ɴ��ƶϳ�Fe3O4�����Ļ��ϼ���+2��+3���֣��ʴ�Ϊ��ACD��
��2�������������̿�֪�����������������ᷴӦ��������������������������Һ���к����������ӣ����������£�ClO3-����Fe2+ΪFe3+����������ԭΪCl-�����ݻ��ϼ����������ƽ����ƽ������ӷ���ʽΪ��6Fe2++ClO3-+6H+�T6Fe3++Cl-+3H2O���ʴ�Ϊ��6Fe2++ClO3-+6H+�T6Fe3++Cl-+3H2O��
��3��KNO3��KOH�Ļ���д������Fe2O3���ȹ����Ƶ�K2FeO4����ȱ������һ��ΪK2FeO4��K2FeO4����Ԫ�ػ��ϼ�Ϊ+6�����������Ӵ�+3�۱�Ϊ+6�ۣ����ϼ�����3�ۣ����ϼ���������3��2=6�ۣ�KNO3��NԪ�ش�+5��ΪKNO2�е�+3�ۣ����ϼ۽���2�ۣ��ϼ���С������Ϊ6��������������ϵ��Ϊ1��KNO3��ϵ��Ϊ3��Ȼ����������غ㶨����ƽ����ƽ��ķ���ʽΪ��Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O��������ΪKNO3��ÿ����1mol K2FeO4ת��3mol���ӣ��ʴ�Ϊ��1��3��2��K2FeO4��3��H2O��HNO3��3��
��4����Fe3+����I-����I2���������������ѡ�������Һ��ָʾ�������������һ�������������Һʱ����ɫ��ʧ���Ұ���Ӳ���ɫ˵�����յ㣬�ʴ�Ϊ�����ۣ���Һ����ɫ����ɫ�ұ��ְ���Ӳ���ɫ��
����2Fe3++2I-�T2Fe2++I2��I2+2S2O32-�T2I-+S4O62-�ɵã�Fe3+��S2O32-����n��Fe3+��=n��S2O32-��=0.1000mol/L��0.02L=0.002mol����Ԫ���ܺ���Ϊ$\frac{56g/mol��0.002mol}{0.02L}$=5.6g/L��
H2O2Ҳ������I-����I2����������������û�г����������������������Һ���ƫ��������ƫ�ߣ��ʴ�Ϊ��5.6��ƫ�ߣ�
���� ���⿼�������ʵ��Ʊ���������ơ��������ӵļ��顢������ԭ��Ӧ��ƽ����ѧ�����֪ʶ����Ŀ�Ѷ��еȣ�����֪ʶ��϶ࡢ�ۺ��Խ�ǿ����һ��������ϵ���Ŀ����ֿ�����ѧ���ķ������������������Ӧ����ѧ֪ʶ��������

| A�� | Na2O2�����ᷴӦ�����κ�ˮ������Na2O2�Ǽ��������� | |
| B�� | Na2CO3����ת����NaHCO3����NaHCO3��ת����Na2CO3 | |
| C�� | ����ͬŨ�ȵ��ᷴӦ�����ʣ�Na2CO3��NaHCO3 | |
| D�� | Na�Ż�ʱ������ĭ�������� |

��1������30%BaS��Һ��������Ͳ���ձ�������������ȱ�ٵ�ʵ��������������ƽ��
��2������п�۱���ԭ��������Fe3+��Cu2+��
��3���������������£�KMnO4��Mn2+ʱ���������ӷ�Ӧ��2MnO4-+3Mn2++2H2O=5MnO2��+4H+��
��4��������ZnSO4���Խ�ǿ���ɲ�ȡ�ļ�ʩ�Ǽ�������п�ۣ�����ֱ���ܽ⣮
��5��������Һ�ϳ����·ۣ�����Ҫ�����»������ˡ�ϴ�ӡ�������ա�ĥ�۵ó�Ʒ��
��6������������·۳�Ʒ�Ȳ����������ԭ����Cu2+��Mn2+��Fe3+û�г�����
��7��ij�о���ѧϰС�����ӷϵ��пƬ ����Ҫ�ɷ�ΪZn��Fe��C�����������Ʊ�����������п��Һ���ٺϳ����·ۣ��벹�������ɷ�пƬ�Ʊ�ZnSO4��Һ��ʵ�鲽��[����г��˼������������������������pH����ʼ������pH����������Ũ��Ϊ1.0mol•L-1���㣩]��
| ��ʼ������pH | ������ȫ��pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
ʵ�鲽������Ϊ��
�����Թ���3.0 mol•L-1 H2SO4�ܽ��пƤ��
�ڼ�������30% H2O2��ʹ���ַ�Ӧ��
��1.0 mol•L-1 NaOH��������ҺpHԼΪ5����3.2��pH��5.9����ʹFe3+������ȫ��
�ܹ��˵���Һ��
��6.72L���� ��3.01��1023HCl���� ��13.6g H2S ��0.2mol NH3��
| A�� | �������ܣ��٣��ۣ��� | B�� | �ܶȣ��٣��ܣ��ۣ��� | ||
| C�� | ������ܣ��٣��ڣ��� | D�� | ��ԭ�������ڣ��ܣ��ۣ��� |
| A�� | Na+Mg2+ Cl- OH- | B�� | H+Ca2+ CO32-NO3- | ||
| C�� | Cu2+K+SO42-NO3- | D�� | Na+ HCO3-OH- Ca2+ |
 �ܻ���DBP���ڱ����������������ҪӦ����PVC�Ⱥϳɲ�����������������Ӧԭ��Ϊ��
�ܻ���DBP���ڱ����������������ҪӦ����PVC�Ⱥϳɲ�����������������Ӧԭ��Ϊ��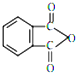 +2CH3CH2CH2CH2OH��
+2CH3CH2CH2CH2OH��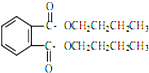 +H2O
+H2O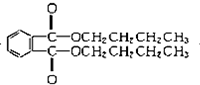 +2NaOH$\stackrel{��}{��}$
+2NaOH$\stackrel{��}{��}$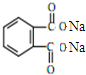 +2CH3CH2CH2CH2OH��
+2CH3CH2CH2CH2OH��